摘要
目的
几乎没有证据表明COVID-19患者血栓形成风险增加。我们的目的是评估严重形式的SARS-CoV-2感染的血栓形成风险。
方法
纳入了2020年3月3日至31日期间因COVID-19引起的急性呼吸窘迫综合征(ARDS)从法国三级医院的两个中心转介到4个重症监护病房(icu)的所有患者。前瞻性地收集病史、症状、生物学资料和影像学资料。采用倾向评分匹配分析非COVID-19 ARDS和COVID-19 ARDS患者血栓栓塞事件的发生情况。
结果
纳入150例COVID-19患者(男性122例,中位年龄63 [53];[71]年,SAPSII 49 [37];64分)。在150例患者中诊断出64例临床相关血栓性并发症,主要是肺栓塞(16.7%)。29例接受持续肾替代治疗的患者中有28例(96.6%)出现循环凝血。12例(8%)经ECMO支持的患者发生3例(2例)离心泵血栓闭塞。大多数患者(95%)d -二聚体和纤维蛋白原升高。无患者发生弥漫性血管内凝血。血管性血友病(vWF)活性、vWF抗原和FVIII明显升高,50/57例(87.7%)狼疮抗凝血剂阳性。与非covid -19 ARDS患者比较(n= 145)确诊COVID-19急性呼吸窘迫综合征患者(n= 77)出现了更多的血栓性并发症,主要是肺栓塞(11.7% vs. 2.1%;p< 0.008)。两组间凝血参数差异有统计学意义。
结论
尽管进行了抗凝治疗,但大量继发于COVID-19的ARDS患者出现了危及生命的血栓性并发症。因此,可能建议高于一般危重病人的抗凝目标。
在一项前瞻性队列研究中,我们发现150例COVID-19 ARDS患者在ICU住院期间诊断出64例临床相关血栓性并发症,主要是肺栓塞(25例,16.7%)。尽管进行了抗凝治疗,但仍有大量COVID-19急性呼吸窘迫综合征患者出现危及生命的血栓性并发症,这意味着可能应考虑比通常危重患者更高的抗凝目标。 |
介绍
SARS-CoV-2感染引起的严重急性呼吸综合征(ARDS)患者,也称为冠状病毒病2019 (COVID‐19),入住重症监护病房(icu)的患者主要出现呼吸道和消化系统症状[1,2].然而,部分患者也可能出现凝血功能障碍,并伴有预后不良[3.].在183例连续患者的回顾性研究中,Tang等人报道,71.4%的非幸存者符合弥散性血管内凝血(DIC)的标准,而只有0.6%的幸存者符合。在99例中国患者中,Chen等。[4]也报告了异常的“凝血功能”,包括36例(36%)患者d -二聚体升高,30例(30%)患者凝血酶原时间(PT)降低,16例(16%)患者活化的部分凝血活素时间(aPTT)增加。同样,在13例ICU住院患者中,Wang等。[5]报道,ICU患者入院时凝血酶原时间和d -二聚体水平明显高于非ICU患者。与脓毒症的情况一样,可能建议重症COVID-19患者预防性抗凝[6].国际血栓与止血学会(ISTH)最近提出了基于标准凝血标志物(d -二聚体、凝血酶原时间、纤维蛋白原和血小板计数)随访的凝血病管理建议[7].在另一项回顾性研究中,Tang等人根据脓毒症诱导凝血病(SIC)评分或d -二聚体水平对患者进行分层。[8表明肝素可以降低符合SIC标准或d -二聚体明显升高的COVID-19重症患者的死亡率。
尽管凝血功能障碍的证据越来越多,但基于这些少数患者的回顾性数据,没有最严重患者(即ICU住院患者)的数据。此外,没有一篇已发表的文章描述与这些凝血障碍相关的临床或放射学问题[3.,4,5].这些结果的临床相关性可能仍然值得怀疑。
在全面临床检查的基础上,以法国一家三级医院两个中心的4个重症监护病房(icu)收治的因SARS - CoV - 2感染而患有ARDS的危重患者的同质前瞻性队列的生物学和放射学数据为基础,我们旨在描述covid -19诱导的血栓性并发症,并将其与非covid -19 ARDS患者进行比较。
患者及方法
病人
在2020年3月3日至3月31日期间,所有因ARDS转介的患者[9在法国一家三级医院的两个中心的四个重症监护病房(icu)住院时前瞻性地纳入了SARS - CoV - 2患者。没有排除标准。病人按照现行指引进行管理[6没有特殊的治疗干预。获得了斯特拉斯堡大学医院当地伦理委员会的批准(参考CE-2020-34)。这项研究包括所有人口统计学特征、病史、临床体征、生物学和影像学数据。数据于4月7日分析,这意味着对最近的患者至少进行了7天的随访。
采用2014年至2019年纳入的“非COVID-19 ARDS”患者(NCT #02391792)的历史前瞻性队列,比较COVID-19 ARDS与非COVID-19 ARDS。所有患者均有根据柏林定义定义的细菌性或病毒性急性呼吸窘迫综合征[9].它们的特点总结在表中1.
结果
主要终点是比较COVID-19 ARDS患者与非COVID-19 ARDS患者的任何血栓事件(深静脉血栓形成、肺栓塞、心肌梗死、肠系膜缺血、下肢缺血、脑缺血发作)的发生率。次要终点是比较上述各血栓性并发症的发生情况、RRT滤过性凝血的发生情况、各RRT回路的中位寿命、ECMO氧合器凝血的发生情况、出血性并发症的发生情况和凝血试验结果。
实验室分析
在ICU住院期间每天进行血小板计数和凝血试验,包括PT、抗凝血酶活性(AT)、纤维蛋白原、d -二聚体和aPTT,以便进行DIC评分。检测因子V (FV)、血管性血友病因子(vWF)抗原、vWF活性和因子VIII (FVIII)活性。当怀疑有凝血障碍时,根据ICU入院时aPTT延长或ICU住院期间血栓事件的发生,寻找狼疮抗凝剂。详情请参阅补充资料。
DIC评分系统
2016年jam - dic评分[10], ISTH overt-DIC评分[11]及SIC评分[8]每日计算至第7天。如果ISTH overt-DIC得分为5分或以上,则认为得分为阳性,如果jam - dic得分为4分或以上,如果SIC得分为4分或以上。
成像
疑似肺栓塞的患者,根据其临床表现(较差的PaO)2/ FiO2尽管吸入一氧化氮或俯卧位或血流动力学损伤需要补充液体和/或去甲肾上腺素输注速率增加,右心室扩张(即使没有急性肺源性心脏病)或实验室参数变化(尽管抗凝,d -二聚体快速升高),在ICU入院或住院期间进行CT肺血管造影(CTPA)。所有CTPA在64 +行扫描仪上获得,注射50-75 mL高浓度碘造影剂后,使用剂量跟踪技术,肺动脉主动脉阈值为160 HU至250 HU。在确定后,根据最近腔缺损的位置,将肺栓塞分为圆形、大叶状、节段性或亚节段性。
对疑似外周动脉缺血的患者行CT血管造影(CTA)检查。下肢CTA在64排机器上进行,注射100 mL高浓度碘造影剂后动脉期。
根据临床表现和/或生物学异常,怀疑肠系膜缺血的患者行胸腹骨盆CT (CAP CT)增强扫描。在注射100 mL高浓度碘造影剂后,在64排机器上获得所有CAP CT,强制无增强,动脉和静脉腹盆腔期。
根据病理神经学检查,怀疑中风的患者进行非对比脑CT和/或弥散加权成像和3D FLAIR成像的脑MRI检查。
所有的CT和MR检查都由专门从事急诊放射学的放射科顾问医师阅读。
统计
连续变量以第一和第三个四分位数的中位数表示,并使用非参数Wilcoxon检验进行比较。分类变量以数字和比例表示,并使用皮尔逊比较χ2或者费雪的精确测试为了比较本观察性研究的结果,进行了倾向评分分析。以组(非COVID-19 ARDS或COVID-19 ARDS)为因变量,以组间不平衡或具有临床相关性的基线特征(年龄、性别、恶性肿瘤病史、心血管疾病、脑血管疾病、静脉血栓栓塞事件、免疫疾病、慢性肝脏疾病、慢性肾脏疾病、呼吸系统疾病、SAPS II、沙发,PaO2/ FiO2ICU入院,抗凝治疗和ECMO)。然后将COVID-19和非COVID-19患者按这些倾向评分进行1:3配对,卡尺尺寸为0.1 × logit[倾向评分的SD]。为了考虑匹配,然后使用具有非结构化协方差矩阵的GEE(广义估计方程)模型对变量进行比较。二元变量采用二项分布,连续变量采用伽玛分布。使用直方图和分位数图评估Gamma分布的拟合优度。采用多变量logistic回归模型对整个人群进行敏感性分析。结果以95%置信区间的优势比表示。一个p值< 0.05认为有统计学意义。所有分析均采用R软件3.6.0进行。(R Core Team(2019))。R:用于统计计算的语言和环境。R统计计算基金会,维也纳,奥地利。URLhttps://www.R-project.org/).
结果
患者的基线特征
本研究纳入了150例连续入住4个icu的实时逆转录酶PCR检测为COVID-19阳性的患者。中位年龄63岁[53岁;71]岁,男女比例为122/28(占男性的81.3%)。简化急性生理评分(SAPS) II的中位数为49 [37];64点。考虑到数据分析时仍插管101例(67.3%),ICU中位住院时间为9.6±4.2天,死亡率为8.7%。截至数据分析时,36例患者已出院。84例(60%)接受洛匹那韦+利托那韦治疗,8例(5.3%)接受瑞德西韦治疗,49例(32.7%)接受羟氯喹治疗,9例(7.5%)未接受任何抗病毒治疗。COVID-19和非COVID-19患者在ICU住院期间的病史、患者特征、血栓/缺血性和出血性并发症汇总于表1.
血栓和缺血性并发症
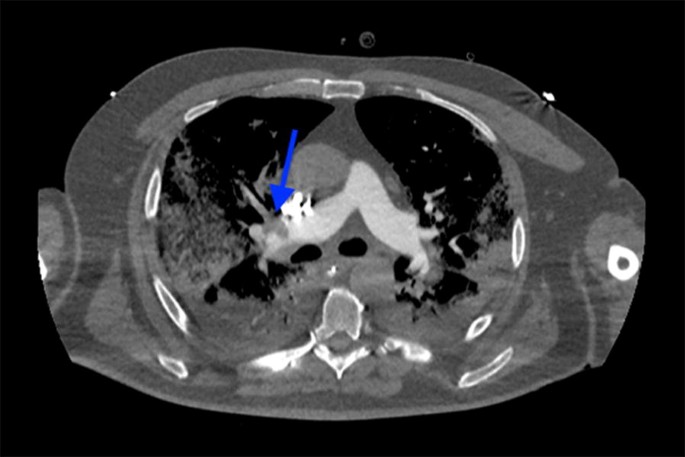
150例患者在ICU住院期间诊断出64种临床相关血栓性并发症,主要是肺栓塞(图2)。1).我们对99名患者进行了100次CTPA检查,以调查呼吸系统再恶化的原因或d -二聚体显著增加的原因。25例(25%)表现为肺栓塞(24例男性,平均年龄62岁):9例为圆形肺栓塞,8例为大叶性肺栓塞,5例为节段性肺栓塞,3例为亚节段性肺栓塞。诊断为肺栓塞的中位数为5.5 [2.8;[9.3] d。
25例患者因神经系统病理检查行15例脑CT和10例脑MRI检查,其中4例出现出血性并发症或缺血性脑卒中。在最近跌倒后头部创伤的背景下进行了两次CT,但没有显示缺血性中风的迹象。其中一名患者右颈内动脉完全闭塞,可能先前存在COVID-19感染,没有任何缺血性中风的迹象。
2例MRI表现为左小脑缺血性脑卒中,1例为急性,弥散加权成像呈高信号,弥散系数降低,另1例因ADC增高,造影增强不足,无肿块效应,可能已存在COVID-19感染;第三例患者双侧多发脑室周围缺血性病变。最后一例有急性额颞实质内大量血肿和多发近期缺血性病变。
29例接受持续肾替代治疗(RRT)的患者中有28例(96.6%)出现了血流凝血。RRT回路的中位寿命为1.5 [1;2]天,而制造商推荐的时间为3天,连续RRT 230天共使用了141个电路(4.9个设备/患者)。
体外膜氧合(ECMO) 12例(8%):11例因呼吸衰竭行静脉-静脉ECMO, 1例因呼吸衰竭并发肺栓塞心源性休克行静脉-动脉ECMO。
我们在2例患者中发现了3个血栓性的离心泵闭塞,第一例患者在运行5天后需要及时更换,第二例患者在运行4天和7天后需要及时更换。
在ICU住院期间,没有患者发生心肌梗死,尽管大量患者(48%)患有心血管合并症。患者62岁,除戒烟20多年及血脂异常外无心血管病史,发生急性肢体缺血。病史显示无下肢动脉闭塞性病变,未接受儿茶酚胺治疗,住院期间无房颤报告。由于持续低氧血症,在同一天进行的CTPA检查中也诊断出节段性肺栓塞。
5例患者怀疑肠系膜缺血,1例CAP CT阳性(30cm非强化肠)。
无患者出现指/趾坏死或紫癜。
抗病毒治疗项目与血栓形成倾向无关(数据未显示)。
出血性并发症
仅4例(2.7%)出现出血性并发症。患者1和2入院前近期有头部外伤;第一个被诊断为轴内血肿;第二个是弥漫性轴内和轴外出血。第三例患者有实质内血肿(如上所述)。第4例患者因ECMO出现出血性并发症,插管插入处(scarpa)出现大量血肿,需要清除血肿并局部凝血。
凝血障碍
在基线时,大多数患者(95%)的d -二聚体和纤维蛋白原水平升高。血小板、凝血酶原时间、aPTT和抗凝血酶分别在120例(80%)、108例(72%)和100例(66.7%)患者正常范围内,这解释了144例(96%)患者JAAM-DIC正常(< 4分)和所有患者ISTH正常(< 5分)的原因。中位评分为0 [0;1]和2 [2,3.jam - dic和ISTH得分分别为]分。只有6例患者(2.7%)有JAAM-DIC评分阳性,没有一例患者有ISTH评分阳性。即使是用于检测患者“有发生DIC风险”的SIC评分,也只有22例(14.7%)患者呈阳性。
血管性血友病因子(vWF)活性、vWF抗原(vWF:Ag)及因子VIII均显著升高。此外,57例患者中有50例(87.7%)在ICU住院期间狼疮循环抗凝剂阳性2).
在4例患者中没有肝素诱导的血小板减少症,因为临床或生物学数据可能与这种诊断相一致。
COVID-19与非COVID-19 ARDS患者的比较
匹配77例COVID-19 ARDS患者或145例非COVID-19 ARDS患者。35例COVID-19患者与1例非COVID-19患者配对,16例COVID-19患者与2例非COVID-19患者配对,26例COVID-19患者与3例非COVID-19患者配对。COVID-19和非COVID-19患者的特征总结见表1结果见表3..性别、年龄、病史、器官衰竭及严重程度评分(脓毒症相关器官衰竭评估- sofa, SAPS II)、PaO2/ FiO2组间比较,基线抗凝治疗和配对后ECMO支持无差异(表2)1).
匹配后评估,COVID-19 ARDS患者诊断出的血栓性并发症多于非COVID-19 ARDS患者(9例(11.7%)vs 7例(4.8%),OR为2.6[1.1-6.1]。p= 0.035),肺栓塞明显更多(9例(11.7%)vs 3例(2.1%),OR为6.2 [1.6-23.4];p= 0.008)。
每位透析患者的RRT回路总数在COVID-19患者中更高,其中位寿命更短(表2)3.).
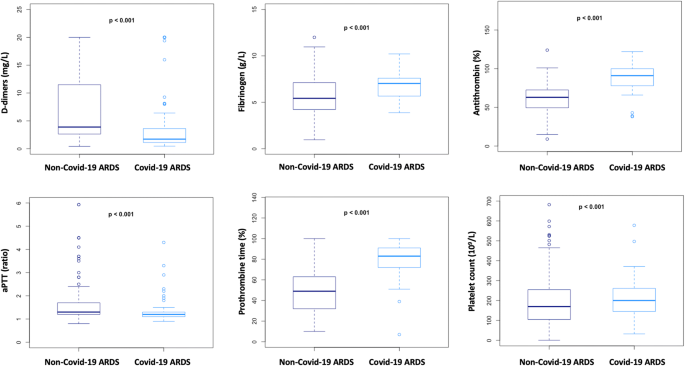
两组间凝血参数也存在差异(图2)。2): COVID-19患者凝血酶原时间、抗凝血酶、纤维蛋白原和血小板水平明显高于非COVID-19 ARDS患者;aPTT和d -二聚体在COVID-19患者中显著降低。
采用多变量logistic回归模型,结合用于构建倾向评分的协变量,进行敏感性分析,比较整个人群中血栓栓塞并发症和肺栓塞的发生率。调整后的优势比与两种事件的倾向评分分析计算的优势比相似(OR = 2.7[1.1-6.6])。p= 0.028, OR = 9.3 [2.2-40];p肺栓塞= 0.003)。
讨论
在一项前瞻性队列研究中,我们证实了在因低氧性急性呼吸衰竭而入住ICU的COVID-19患者中,临床相关血栓形成的发生率很高,主要是肺栓塞(16.7%)。这些血栓并发症发生尽管预防性或治疗性抗凝。
通过高纤维蛋白原评估的全身性炎症反应综合征在所有患者中都存在,并且几乎所有COVID-19患者的凝血激活都是由进行性d -二聚体升高所证明的。然而,凝血激活模式与我们的非covid -19 ARDS患者队列不同。这与没有DIC的感染性休克也不一样:d -二聚体水平升高较少(2.27 mg/L vs. 4.30), PT、aPTT和AT在正常范围内,纤维蛋白原较高(7.0 g/L vs. 5.6) [12].有趣的是,30-40%的脓毒性休克患者会发生DIC [13],使用ISTH“显性”评分诊断为DIC的COVID-19患者无一例,使用jam -DIC评分诊断为DIC的患者仅有6例。即使是用于检测DIC风险的SIC评分,也只有22例患者呈阳性。
因此,我们可以合理地假设,导致COVID-19患者DIC的机制与ICU患者通常描述的机制不同。因此,导致局部血栓形成(PE、卒中或肠系膜梗死)或电路装置血栓形成(RRT或ECMO)的机制可能也不相同。事实上,尽管通过持续输注肝素和/或柠檬酸盐进行全身抗凝,RRT回路血栓形成[14],这可能是由于纤维蛋白原水平很高和超滤导致透析器毛细血管内的浓度较高,而不是由于电路本身的接触相激活[15].经典凝血标志物、凝血酶原和活化凝血活素时间、血小板计数不能检测促凝状态[16].
我们的数据显示,肺栓塞通常在ICU入院几天后被诊断出来。通过与非COVID-19患者的匹配评估,COVID-19 ARDS的肺栓塞发生率要高得多(11.7%对2.1%)。另一项前瞻性队列研究报告,危重患者的PE仅为1.3% [17].
血栓形成的机制尚不清楚。内皮炎症明显,vWF:Ag和FVIII水平非常高。肺毛细血管深度低氧血症可导致血管收缩,减少血流量,促进血管闭塞[18].低氧血症还会诱导低氧诱导因子(hif)的激活。hif是由所有有核细胞表达的HIFβ亚基、HIF1α和HIF2α亚基(分别为HIF1和HIF2)组成的异二聚体转录因子。缺氧诱导HIF2α亚基并降低羟基化,从而诱导或抑制许多基因,包括组织因子(TF)和纤溶酶原激活物抑制剂-1 (PAI-1) [19,20.].我们没有测量患者的PAI-1,但我们可以假设它会非常高,因为它是由内皮细胞如vWF脱落的。
在健康的肺中,宿主凝血和纤溶途径之间存在良好的平衡,控制纤维蛋白沉积及其对肺上皮活力的影响。众所周知,尿激酶纤溶酶原激活剂(uPA)与其受体(uPAR)结合可提高上皮细胞表面纤维蛋白溶解的效率,从而清除肺部异常的纤维蛋白沉积[21].在肺部炎症期间,这种纤维蛋白溶解功能受损,导致促凝活性增加,导致纤维蛋白在肺泡间隙异常积聚[22].因此,来自ARDS患者的支气管肺泡灌洗(BAL)液的数据显示,纤维蛋白的存在和uPA纤溶酶原激活物抑制剂1 (PAI-1)水平的升高导致肺泡内纤维蛋白溶解活性降低[23].在2002-2003年流行期间,在sars - cov感染患者的血液中检测到PAI-1水平升高[24].由于由纤维蛋白和蛋白质物质组成的渗出物阻碍了正常的气体交换,切割和清除纤维蛋白沉积物的能力降低与患者的临床预后不良相对应[25].
最近,Gralinsky等人[26]利用系统生物学和提供匹配病毒学、病理学和转录组学数据的严重急性呼吸综合征冠状病毒(SARS-CoV)模型病原体,得出了一个由促凝剂和抗纤溶因子表达定义的止血平衡改变模型,导致感染后肺泡弥漫性损伤。因此,我们认为SARS-CoV感染破坏了通常具有保护作用的纤原蛋白溶解途径,包括PAI-1表达的增加,导致了严重的ARDS。
另一个可能导致血栓形成的因素是狼疮抗凝剂(LA)阳性的存在,57例测试中有50例(87.7%)检测到。我们可以合理地排除由于肝素的存在而导致的假阳性LA,因为大多数患者的肝素含量< 0.3 IU/mL,并且dRVV试剂中含有肝素中和剂,可将肝素猝灭至0.8 anti - Xa IU/mL。LA是在各种临床情况下检测到的异质抗体,当细胞因感染、自身免疫或炎症刺激而损伤时[27导致质膜重塑,包括膜微粒的释放和免疫系统通常无法接触到的磷脂的暴露。由此产生的抗体被命名为抗磷脂抗体(anti- phosphollipantibodies, aPL)。引人注目的是,在大部分COVID-19患者中,这种LA/aPL升高很少在其他病理中观察到,这可能表明严重或大量的细胞破坏。当然,我们不能排除一些患者在感染COVID-19之前就已经是LA阳性,因为无症状性LA阳性的频率在老龄化人群中更高[28].
然而,在COVID-19病程早期,高d -二聚体、血栓形成和LA存在之间存在密切关联。此外,2例患者有网状脂肪肝,1例患者在48 MPL时有IgM型抗心磷脂抗体。在我们的队列中,29名患者患有急性肾衰竭(ARF) KDIGO3,需要肾脏替代治疗(19.3%),许多患者有较轻的肾功能衰竭伴蛋白尿(数据未显示)。入院时常出现肾功能衰竭,而不存在低血压。ARF的发病机制可能是多因素的。它可能与脱水、血管渗漏、缺氧和apl相关肾病有关。由于没有进行肾活检,我们的患者血栓性微血管病变的证据很难证明。在甲型H1N1流感期间观察到,全身性炎症(主要通过il -6)可能导致肾脏损伤[29]及急性呼吸窘迫综合症[30.].ARF作为一个放大回路[31].然而,一些患者入院时伴有急性肾功能衰竭,而入院前几天临床表现明显的脱水和水样腹泻。有趣的是,这些患者在水合作用下恢复利尿,但ARF没有改善,这说明了一个复杂的机制。过度水合是急性呼吸窘迫综合征(ARDS)期间的主要问题,高静脉压(由高PEEP加重)和肾脏静脉充血也可能在ICU住院期间发生ARF中发挥作用。
已知有些病毒可激活凝血级联反应,主要是通过促进内皮细胞(HSV和登革病毒)以及淋巴巨噬细胞和循环血细胞(埃博拉病毒)上的组织因子[32].登革热病毒和埃博拉病毒的临床表现是传播性血管内凝血并伴有出血性模式[33].我们的COVID-19患者没有这种表型,但具有高度血栓性,没有DIC的证据。此外,该表型也不同于因细菌性肺炎而入院ICU的ARDS患者,可能是COVID-19的特异性表现。
由于是观察性的,我们的研究有一些局限性。值得注意的是,我们无法描述导致COVID-19患者临床相关血栓形成高发的病理生理假说,但我们基于临床和生物学的考虑提出了一些假说。由于收集数据时仍有大量COVID-19患者仍在插管,因此血栓性并发症的发生率可能被低估。最后,我们没有对血栓栓塞事件进行系统的标准化评估,成像是根据临床或实验室参数的演变进行的,这可能会导致治疗医生的差异。
该研究证实,尽管有抗凝治疗,但大量继发于COVID-19的ARDS患者仍会出现危及生命的血栓并发症。由于这种特殊病理中标准止血参数的变化,抗凝治疗的监测应通过抗xa测量来实现。尽管Tang等人[3.[5]提示,在符合SIC标准或d -二聚体明显升高的重症COVID-19患者中,以低分子肝素为主的抗凝治疗似乎与更好的预后相关,可能应考虑比平时更高的抗凝靶点。
数据可用性
所有可用的数据都发表在当前的手稿中。
参考文献
Glass WG, Subbarao K, Murphy B, Murphy PM(2004)严重急性呼吸综合征冠状病毒(SARS-CoV)肺部感染小鼠的宿主防御机制。[J]中华医学杂志
伊曼埃尔,李建军,李建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军。(2020)新型冠状病毒肺炎疫情下的医疗资源公平分配。[英]医学。https://doi.org/10.1056/NEJMsb2005114
唐宁,李丹,王鑫,孙忠(2020)新型冠状病毒肺炎患者凝血参数异常与预后不良相关。J血栓出血。https://doi.org/10.188金宝慱官网下载1111/jth.14820
陈N,周董X, J,龚F,汉族Y,邱Y,王J,刘Y, Y,夏J,余T,张X,张L(2020)流行病学和临床特点的新型冠状病毒肺炎99例2019武汉,中国:一个描述性的研究。柳叶刀395:507 - 513
王东,胡斌,胡超,朱峰,刘霞,张军,王斌,向宏,程铮,熊燕,赵燕,李燕,王鑫,彭铮(2020)武汉市138例2019年新型冠状病毒感染的肺炎住院患者临床特征分析。《美国医学协会杂志》上。https://doi.org/10.1001/jama.2020.1585
罗兹,埃文斯勒,Alhazzani W,利维MM,安东内利M,费雷尔R,库马尔,Sevransky我,迅速CL, Nunnally我,Rochwerg B·鲁本菲尔德GD,安格斯,Annane D,加州Beale RJ Bellinghan GJ,伯纳德•GR Chiche JD, Coopersmith C,德支持者DP,法国CJ Fujishima年代,Gerlach H,伊达尔戈杰,Hollenberg SM,琼斯AE,·卡纳德博士,Kleinpell RM, Koh Y,葡京TC, Machado FR,马里尼JJ,马歇尔JC Mazuski我,麦金太尔,麦克莱恩,梅塔,莫雷诺RP, Myburgh J, Navalesi P, Nishida O,奥斯本TM,佩尔奈,Plunkett CM, Ranieri M, Schorr CA, Seckel MA, Seymour CW, Shieh L, Shukri KA, Simpson SQ, Singer M, Thompson BT, Townsend SR, Van der Poll T, Vincent JL, Wiersinga WJ, Zimmerman JL, Dellinger RP(2017)脓毒症生存运动:脓毒症和脓毒性休克管理的国际指南;2016。重症监护医学43:304-377
Thachil J, Tang N, Gando S, Falanga A, Cattaneo M, Levi M, Clark C, Iba T(2020)新冠肺炎患者凝血功能障碍的识别和管理。J血栓出血。https://doi.org/10.188金宝慱官网下载1111/jth.14860
唐宁,白华,陈鑫,龚健,李丹,孙忠(2020)新型冠状病毒肺炎合并凝血功能障碍患者抗凝治疗与死亡率降低相关。血栓病,血栓病https://doi.org/10.188金宝慱官网下载1111/JTH.14817
张建军,张建军,张建军,张建军。(2012)急性呼吸窘迫综合征的研究进展。JAMA 307:2526 - 2533
Iba T, Di Nisio M, Thachil J, Wada H, Asakura H, Sato K, Kitamura N, saiitoh D(2016)日本急性医学协会(JAAM)弥散性血管内凝血(DIC)诊断标准的修订。急救护理20:28 . 7
Taylor FB Jr, Toh CH, Hoots WK, Wada H, Levi M,国际血液止血学会弥散性血管内凝血科学小组委员会(2001)弥散性血管内凝血的定义、临床和实验室标准及评分系统。血栓病86:1327-1330
deabranche X, Boisrame-Helms J, Asfar P, Berger A, motien Y, Lavigne T, Grunebaum L, Lanza F, Gachet C, Freyssinet JM, Toti F, Meziani F(2013)感染性休克引起的弥散性血管内凝血病的新生物标志物。重症监护医学39:1695-1703
deabranche X, Quenot JP, Lavigne T, Mercier E, Francois B, Severac F, Grunebaum L, Mehdi M, Zobairi F, Toti F, Meziani F, Boisrame-Helms J,脓毒性休克弥散性血管内凝血早期检测的临床研究[J]。急救医学44:e930-e939
Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera RH, Derksen RH, de Groot PG, Koike T, Meroni PL, Reber G, Shoenfeld Y, Tincani A, Vlachoyiannopoulos PG, Krilis SA(2006)关于明确抗磷脂综合征(APS)分类标准更新的国际共识声明。[J]《血栓病杂志》4:295-306
Gershom ES, Sutherland MR, Lollar P, Pryzdial EL(2010)单纯疱疹病毒启动的血浆凝固的接触期和内在途径的参与。[J]血栓病杂志[J] 8:1037-1043
Oudemans-van Straaten HM(2015)持续肾替代治疗中的止血和血栓形成。Semin血栓止血41:91-98
Lim W, Meade M, Lauzier F, Zarychanski R, Mehta S, Lamontagne F, Dodek P, McIntyre L, Hall R, Heels-Ansdell D, Fowler R, Pai M, Guyatt G, Crowther MA, Warkentin TE, Devereaux PJ, Walter SD, Muscedere J, Herridge M, Turgeon AF, Geerts W, Finfer S, Jacka M, Berwanger O, Ostermann M, Qushmaq I, Friedrich JO, Cook DJ, Investigators prticct(2015)内外科危重患者抗凝血预防失败的危险因素。急救医疗43:401-410
王晓明,王晓明(2017)低氧肺血管收缩对血管内皮细胞的影响。[J] .中国生物医学工程学报(英文版)
杨世峰,杨建平,杨建平,杨建平(1999)缺氧/低氧诱导的促凝血途径的激活和缺血相关血栓形成的机制。动脉粥样硬化血栓血管生物学19:29 - 2035
古普塔娜,赵艳艳,Evans CE(2019)缺氧对血栓形成的刺激作用。《悸动》181:77-83
李春华,李春华,李春华,李春华。(1999)尿激酶型纤溶酶原激活物受体在肺纤维蛋白清除中的作用。[J] .中国生物医学工程学报,2011,31 (3):533 - 536
张建军,张建军,张建军,张建军,张建军,张建军,等(1990)呼吸窘迫综合征患者支气管肺泡尿激酶活性降低的临床意义。中华医学杂志32:890 - 897
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。(1989)成人呼吸窘迫综合征中凝血和纤溶途径的局部异常与肺泡纤维蛋白沉积的关系。中华临床医学杂志(84):695 - 705
吴玉萍,魏锐,刘志华,陈斌,Lisman T,任道林,韩建军,夏志林,张福生,徐文博,Preissner KT, de Groot PG(2006)严重急性呼吸综合征(SARS)患者血栓形成因素分析。血栓出血96:100-101
陈晓明,陈晓明,陈晓明,陈晓明。(2005)急性呼吸窘迫综合征患者体位直立对气体交换的影响。[J]重症监护医学20:43-49
Gralinski LE, Bankhead A 3rd, Jeng S, Menachery VD, Proll S, Belisle SE, Matzke M, Webb-Robertson BJ, Luna ML, Shukla AK, Ferris MT, Bolles M, Chang J, Aicher L, Waters KM, Smith RD, Metz TO, Law GL, Katze MG, McWeeney S, Baric RS(2013)严重急性呼吸综合征冠状病毒致急性肺损伤机制。mBio 4: e00271
Giannakopoulos B, Krilis SA(2013)抗磷脂综合征的发病机制。[J] .中华医学杂志,368:1033-1044
高德曼- mazur S, Wypasek E, Karpinski M, Stanisz A, Undas A(2019)使用标准化方案筛查50岁以上门诊患者抗凝血酶缺乏和抗磷脂综合征的高检出率。Thromb Res 176:67-73
Bautista E, Arcos M, Jimenez-Alvarez L, Garcia-Sancho MC, Vazquez ME, Pena E, Higuera A, Ramirez G, Fernandez-Plata R, Cruz-Lagunas A, Garcia-Moreno SA, Urrea F, Ramirez R, Correa-Rotter R, Perez-Padilla JR, Zuniga J (2013) A/H1N1病毒感染与急性呼吸窘迫综合征和肾损伤相关的血管生成和炎症标志物。药理实验,94:486-492
Seeley EJ(2013)急性肺损伤管理的最新进展:关注AKI和ARDS之间的重叠。Adv慢性肾脏病20:14-20
马丽娟,王晓明,王晓明,等(2018)肾源性急性呼吸窘迫综合征的病理生理及治疗进展。中华创伤杂志21:4-10
陈建军,陈建军,陈建军,等(2014)凝固蛋白酶级联在病毒感染中的作用。血123:2605 - 2613
Basler CF(2017)病毒性出血热的分子发病机制。Semin Immunopathol 39:551-561
资金
NA。
作者信息
作者及单位
财团
贡献
所有署名的作者都对研究的构思和设计、数据的获取或数据的分析和解释做出了重大贡献。
相应的作者
道德声明
利益冲突
作者无利益冲突需要申报。
伦理批准
斯特拉斯堡大学医院当地伦理委员会批准了该研究(参考CE-2020-34)。
额外的信息
出版商的注意
b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
电子补充资料
以下是电子补充材料的链接。
权利和权限
关于本文
引用本文
Helms, J., Tacquard, C., Severac, F.。et al。严重SARS-CoV-2感染患者血栓形成的高风险:一项多中心前瞻性队列研究重症监护46中文信息学报,1089-1098(2020)。https://doi.org/10.1007/s00134-020-06062-x
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1007/s00134-020-06062-x
关键字
- 新型冠状病毒肺炎
- ARDS
- 血栓形成
- 狼疮抗凝剂
- 凝血障碍