文摘
COVID-19大流行与神经症状和并发症包括中风相关联。有血凝过快与COVID-19可能“sepsis-induced凝血病”,可能引起中风。SARS-CoV-2病毒结合血管紧张素转换酶2 (ACE2)出现在大脑内皮细胞和平滑肌细胞。ACE2的关键部分是肾素血管紧张素系统(RAS)和血管紧张素转换酶的平衡1(傻乎乎)和血管紧张素ⅱ。血管紧张素ⅱ是促炎,vasoconstrictive,促进器官损伤。损耗的ACE2 SARS-CoV-2可能使局面有利于“有害”傻乎乎/血管紧张素ⅱ轴和促进组织损伤包括中风。有一个理由继续治疗与组织纤溶酶原激活物COVID-19-related中风和低分子量heparinoids可能降低血栓形成和死亡率sepsis-induced凝血障碍。
虽然确切的发病率是未知的,中风是新兴的并发症COVID-19大流行。COVID-19的临床过程是最严重的老年患者,男性,和患者的并发症,如高血压、糖尿病、心脏病、肥胖、中风的危险因素。(1]。神经系统症状是常见的COVID-19包括嗅觉缺失症和味觉减退,癫痫发作和中风。214 COVID-19住院患者的回顾性研究从武汉,中国5.7%的严重病人中风(2]。
凝血障碍
新兴的严重COVID-19特点之一是凝血障碍,称为“sepsis-induced凝血病”(原文如此)肺动脉栓塞高水平和高纤维蛋白原3,4]。碳化硅是一种前体DIC及与高凝血酶原时间(PT),肺动脉栓塞升高,血小板减少,但没有hypofibrinogenemia。它与一个侵染诱导系统性炎症反应和内皮功能障碍和microthrombosis器官衰竭和通常不出血4]。多变量分析的一系列回顾440年严重COVID-19病人,28天死亡率的预测是年龄、凝血酶原时间,肺动脉栓塞的水平,和血小板减少。高架肺动脉栓塞患者或碳化硅得分较低死亡率与肝素治疗时(主要是低分子量)相比,那些不与肝素治疗。一系列案例3患者呼吸衰竭和肺动脉栓塞水平高瞬态改善呼吸参数使用组织纤溶酶原激活物(5]。病人的肺部病理COVID-19显示微血管血栓表明肺微血管血栓COVID-19患者可能导致呼吸衰竭和ARDS [5]。
Antiphospholipid抗体(aPL)报告了3 COVID-19病人。aPL是抗体针对磷蛋白质和相关的动脉和静脉血栓事件。所有3例多发性脑梗塞,有多个肢体缺血。IgA anticardiolipin抗体升高和高架IgA免疫球蛋白β2糖蛋白抗体与长期激活局部血栓形成质次,凝血酶原时间但是没有狼疮抗凝。的两个3例血小板减少症,所有高c反应蛋白水平(6]。目前还不清楚如果中风和血栓事件有关碳化硅或aPL。有一个协会aPL和丙型肝炎病毒感染特别是hiv - 1和这些与血栓事件相关联的子群(7,8]。
ACE2的损耗和内皮功能障碍
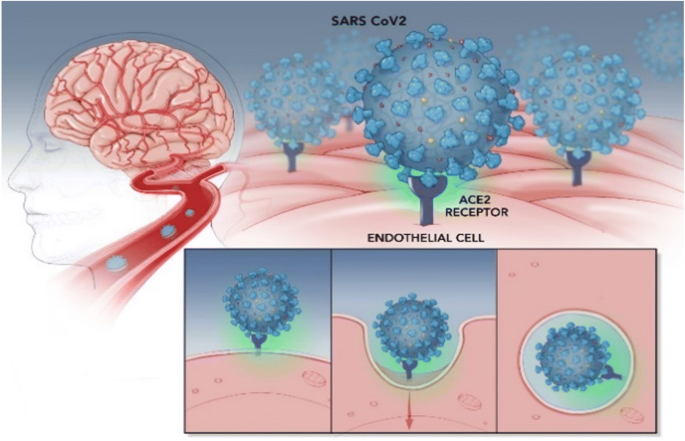
COVID-19大流行是由SARS-CoV-2引起的病毒,冠状病毒家族的一员。SARS-CoV-2病毒结合的血管紧张素转换酶2 (ACE2)通过其峰值(S)的蛋白质(9]。跨膜蛋白丝氨酸蛋白酶2 (TMPRSS2)也要求病毒进入细胞(10]。同样,这种病毒导致了2003年SARS疫情,SARS-CoV-1,也结合ACE2 [11,12]。ACE2是dipeptidyl carboxydipeptidase,同系物的血管紧张素转换酶1(傻乎乎)和肾素血管紧张素系统(RAS)的一部分。肾素分泌肾脏球旁细胞裂解产生的血管紧张肽原肝脏血管紧张素I .血管紧张素I是裂解傻乎乎血管紧张素ⅱ。血管紧张素ⅱ结合血管紧张素1 (AT1)和血管紧张素2受体(at₂)及其绑定AT1导致血管收缩,与钠和水的潴留,醛固酮分泌促炎和procoagulation效果和高血压。血管紧张素ⅱ加重心力衰竭恶化ARDS。AT1受体阻滞剂广泛应用抗高血压药物和器官保护包括大脑有有益的影响。
ACE2抵消傻乎乎,血管紧张素ⅱ。ACE2与血管紧张素(1 - 7)和直接劈开血管紧张素ⅱ劈开血管紧张素I血管紧张素(1 - 9),然后进一步裂解血管紧张素(1 - 7)。血管紧张素(1 - 7)产生血管舒张和抗炎作用通过其绑定到Mas受体。激活ACE2 /盎(1 - 7)/ Mas轴导致有益心血管和神经保护行动counter-regulate傻乎乎的有害行为/血管紧张素ⅱ/ AT1轴(了13,14])。中风的啮齿动物模型中,血管紧张素(1 - 7)是神经保护和抗炎15,16,17]。
ACE2表达在人类肺、小肠、血管内皮和平滑肌细胞在人类的大脑18]。ACE2在小鼠神经元中表达的也是18]。超表达ACE2的神经元细胞或内皮祖细胞保护大脑免受缺血性中风(19,20.]。
SARS-CoV-1并通过受体的内吞作用于病毒病毒耗尽ACE2条目,离开傻乎乎无对手的血管紧张素ⅱ的生成。血管紧张素ⅱ加重肺损伤也加重内皮功能的器官,如心脏和大脑。ACE2肺会随着年龄的增长而减少,减少与年龄大于男性,女性(21]。与此同时,ACE1-angiotensin II系统活动随着年龄的增加(22]。ACE2的损耗由SARS-CoV-2病毒加上ACE2与年龄相关的下降和增加ACE-1-Ang二世技巧有利于平衡ACE-1 /血管紧张素ⅱ与促炎和器官损害的影响。这或许可以解释在老年人和死亡率较高的男性COVID-19大流行。
COVID-19研究的障碍之一是缺乏啮齿动物模型。非典1和2结合ACE2但老鼠和老鼠ACE2并不贪婪地结合的蛋白质和老鼠不发展成严重疾病。人性化ACE2转基因老鼠发达后SARS流行与严重的SARS感染的肺模型人类疾病(23]。使用SARS-CoV-1和2需要BSL-3设施。中风在啮齿动物模型将需要使用人性化ACE2老鼠或转移到其他动物如雪貂中常用的流感疾病的模型。
治疗
对COVID-19和中风患者来说,这似乎是合理与tPA治疗。还不清楚其他抗凝血剂,如低分子量肝素(LMWH)或完全应该使用剂量肝素。有证据表明,在SIC LMWH可能有用。更“有针对性的”COVID-19疗法,一个很有前景的治疗方法是供应外生ACE2的管理重组人可溶性ACE2 (hrsACE2)抑制SARS-CoV-2工程人工血管感染瀑样(24]。重组人可溶性ACE2在飞行员临床试验安全ARDS [25),是COVID-19进入临床试验。(ClinicalTrials.govNCT04335136)。
重组ACE2可能工作主要体现在两个方面:(1)与SARS S蛋白竞争结合肺癌和内皮内生ACE2从而充当诱饵,以减少感染的宿主细胞;(2)防止ACE2 SARS2损耗的病毒。因为ACE2表达的大脑内皮细胞和神经细胞,病毒介导ACE2的损耗可能会损害内皮功能,易诱发或加重急性中风(图。1)。
其他治疗目标RAS系统如血管紧张素(1 - 7),已经显示出承诺在中风临床前模型也可能有前途的治疗COVID-19。血管紧张素(1 - 7)在临床试验COVID-19(临床Trials.govNCT04332666)。此外,AT1受体阻断剂(arb),如洛沙坦,可以保护在中风。虽然已经有一些担心,ARBs药物和血管紧张素转换酶抑制剂可能有害COVID-19病人通过增加ACE2表达和SARS-CoV-2绑定,从美国心脏协会的联合声明,美国心脏病学会和心脏衰竭社会美国建议arb和拮抗剂的RAS系统继续在COVID-19病人可能是有效的。https://www.acc.org/latest-in-cardiology/articles/2020/03/17/08/59/hfsa-acc-aha-statement-addresses-concerns-re-using-raas-antagonists-in-covid-19
总结
中风被报告为COVID-19的并发症。原因还不清楚,但SIC与COVID-19和可能导致内皮功能障碍,microthrombosis,和中风。aPL的角色,可能病毒感染引发的,目前还不清楚,可能与原文如此。
绑定和ACE2的损耗可能提示RAS资产赞成ACE-1-angiotensin II-AT1轴和导致内皮功能障碍,器官损伤和中风。
引用
周F,余T, Du R, et al .临床课程和成人COVID-19患者死亡率的危险因素在武汉,中国:一个回顾性队列研究。《柳叶刀》杂志。2020;395:1054 - 62。https://doi.org/10.1016/s0140 - 6736 (20) 30566 - 3。
王毛L, M,陈,他问,Chang J,香港C, et al .住院患者的神经系统症状COVID-19在武汉,中国:回顾性病例系列研究。SSRN电子j . 2020。https://doi.org/10.2139/ssrn.3544840。
唐N,白H,陈X,龚J,李D,太阳z抗凝治疗与降低死亡率在2019年严重的冠状病毒疾病患者凝血障碍。J Thromb Haemost》2020。https://doi.org/10.188金宝慱官网下载1111/jth.14817。
Iba T,利维JH, Warkentin TE Thachil J, van der调查T,李维m .诊断和管理sepsis-induced的凝血障碍和播散性血管内凝血。17 J Thromb Haemost。2019; (11): 1989 - 94。https://doi.org/10.188金宝慱官网下载1111/jth.14578。
,王J N,摩尔EE,麦金太尔RC,摩尔PK, Veress洛杉矶,等。组织纤溶酶原激活物(tPA)治疗COVID-19相关急性呼吸窘迫综合征(ARDS):一个案例系列。J Thromb Haemost。2020年4月。https://doi.org/10.188金宝慱官网下载1111/jth.14828。
抗磷脂抗体抗体及严重性张y .凝血障碍患者Covid-19。郑传经地中海J。2020; 382: e38。
先尼D,移液管JC, Cacoub p . Antiphospholipid抗体,Antiphospholipid综合症和感染。Autoimmun启2008;7:272-7。https://doi.org/10.1016/j.autrev.2007.10.001。
躲开N, Lopez-Olivo MA Pinto-Patarroyo GP, Suarez-Almazor我。系统回顾antiphospholipid综合症感染后的案例报告。狼疮。2016;25:1520-31。https://doi.org/10.1177/0961203316640912。
周P,杨xl,王X-G,胡锦涛B,张L,张W, et al .肺炎爆发与一种新的冠状病毒相关的可能的起源。大自然。2020;579 (7798):270 - 3。https://doi.org/10.1038/s41586 - 020 - 2012 - 7。
霍夫曼M, Kleine-Weber H,施罗德年代,克鲁格N, Herrler T,埃氏年代,et al . SARS-CoV-2细胞进入取决于ACE2 TMPRSS2和被临床证实蛋白酶抑制剂。细胞。2020;181:1-10。https://doi.org/10.1016/j.cell.2020.02.052。
李W,摩尔MJ, Vasllieva N,等。血管紧张素转换酶2是一个功能性的SARS冠状病毒的受体。大自然。2003;426:450-4。https://doi.org/10.1038/nature02145。
库恩JH,李W, Choe H,大学生m .血管紧张素转换酶2:SARS冠状病毒的受体功能。细胞摩尔生命科学。2004;61 (21):2738 - 43。https://doi.org/10.1007/s00018 - 004 - 4242 - 5。
徐P, Sriramula年代,潜能e·拉扎迪戈ACE2 / ANG - (1 - 7) / Mas途径:良好的轴。是杂志Regul中国Comp杂志。2011;300(4):804 - 17所示。https://doi.org/10.1152/ajpregu.00222.2010。
Arendse磅,简在啊,Poglitsch M,等。新型治疗方法针对肾素-血管紧张素系统和相关肽在高血压和心力衰竭。杂志2019年启,71 (4):539 - 70。https://doi.org/10.1124/pr.118.017129。
美联社麦加,Regenhardt RW,奥康纳TE,约瑟夫·摩根大通Raizada可,Katovich MJ, et al。Cerebroprotection血管紧张素- (1 - 7)endothelin-1-induced缺血性中风。Exp杂志。2011;96 (10):1084 - 96。https://doi.org/10.188金宝慱官网下载1113/expphysiol.2011.058578。
Regenhardt RW, Desland F,美联社麦加,Pioquinto DJ,阿夫扎尔,Mocco J,等。抗炎作用的血管紧张素-(1 - 7)在缺血性中风。神经药理学。2013;71:154 - 63。https://doi.org/10.1016/j.neuropharm.2013.03.025。
Regenhardt RW,麦加美联社,Desland F, Ritucci-Chinni PF,卢丁是的,格林斯坦D, et al。集中管理血管紧张素-(1 - 7)增加病患者的生存自发性高血压大鼠。Exp杂志。2014;99(2):442 - 53年。https://doi.org/10.188金宝慱官网下载1113/expphysiol.2013.075242。
Doobay MF, Talman LS, Obr TD,田X, Davisson RL,潜能e·拉扎迪戈微分表达神经元ACE2与超表达转基因老鼠大脑的肾素-血管紧张素系统。是杂志Regul中国Comp杂志。2007;292:r373 - 81。https://doi.org/10.1152/ajpregu.00292.2006。
陈J,陈小X,年代,张C,陈J,彝族D,等。血管紧张素转换酶2启动增强内皮祖细胞的作用及其治疗效果。高血压。2013;61 (3):681 - 9。https://doi.org/10.1161/HYPERTENSIONAHA.188金宝慱官网下载111.00202。
陈J,赵Y,陈年代,王J,小X, X, et al .神经元表达ischemia-induced ACE2保护大脑的损伤。神经药理学。2014;79:550-8。https://doi.org/10.1016/j.neuropharm.2014.01.004。
Xudong X, Junzhu C, Xingxiang W,芙蓉Z,赵巍译l . ACE2表达的年龄和性别差异在鼠肺。生命科学。2006;78 (19):2166 - 71。https://doi.org/10.1016/j.lfs.2005.09.038。
王米,Monticone再保险,Lakatta如。Proinflammation衰老的中央动脉:原子力。老年医学。2014;60:519-29。https://doi.org/10.1159/000362548。
内特兰德J, Meyerholz DK,摩尔年代,卡塞尔M,帕尔曼美国严重急性呼吸系统综合症冠状病毒感染导致神经元死亡没有脑炎小鼠转基因对人类ACE2。J微生物学报。2008;82 (15):7264 - 75。https://doi.org/10.1128/jvi.00737-08。
Monteil V, Kwon H,普拉多P, Hagelkruys Wimmer RA。抑制SARS-CoV-2工程感染人体组织使用人类ACE2 clinical-grade可溶性。2020年。https://doi.org/10.1016/j.cell.2020.04.004。
汗一个,Benthin C, B,芝诺艾伯森TE,博伊德J,克里斯蒂JD,等。重组人血管紧张素转换酶2的飞行员的临床试验在急性呼吸窘迫综合征。暴击治疗。2017;21 (1):1 - 9。https://doi.org/10.1186/s13054 - 017 - 1823 - x。
确认
科尔比詹,硕士医疗Illustrator,奥古斯塔大学神经外科学系的人物。
资金
大卫·C赫斯收到资金R01 NS099455 1 uo1ns113356, R01NS112511。
作者信息
作者和联系
相应的作者
道德声明
的利益冲突
大卫·C赫斯博士是一个生物的顾问阿鲁娜,公司和接收费用咨询和接收从Athersys特许使用金,Inc . (Wael Eldahsahn博士没有利益冲突和利益冲突。伊丽莎白资助没有利益冲突和利益冲突。
伦理批准
这篇文章不包含任何与人类参与者或动物研究由作者。
额外的信息
出版商的注意
施普林格自然保持中立在发表关于司法主权地图和所属机构。
权利和权限
关于这篇文章
引用这篇文章
赫斯特区。,Eldahshan, W. & Rutkowski, E. COVID-19-Related Stroke.Transl。中风Res。11,322 - 325 (2020)。https://doi.org/10.1007/s12975 - 020 - 00818 - 9
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1007/s12975 - 020 - 00818 - 9
关键字
- COVID-19
- SARS-CoV-2
- 中风
- 脓毒症
- 凝血障碍
- 血管紧张素转换酶2 (ACE2)