文摘
CD4+CD25+调节性T细胞(Treg)进入二级淋巴器官和地方扩张他们的免疫抑制功能的关键。长期应用sphingosine-1磷酸受体激动剂FTY720对多效性的抗炎效果,而短期FTY720增强抗病毒免疫。在这项研究中,我们提供了证据表明,FTY720强有力地抑制Treg体外和体内增殖而不影响他们的生存能力,表型或体外免疫抑制。相比之下,过继转移Treg体外暴露FTY720失去保护作用在急性肾小球肾炎和急性graft-vs-host疾病的小鼠模型。在细胞水平,FTY720抑制IL-2-induced STAT-5磷酸化,平行的损失FoxP3表达在体外Treg扩张。值得注意的是,体内免疫抑制损失不是由于迁移到受损或二级淋巴器官内定位。我们甚至可以显示一个收养的选择性捕获Treg FTY720炎性淋巴结的转移。最后,Treg孤立从动物系统暴露于FTY720也表现出显著增生性反应受损引发刺激相比,Treg隔绝solvent-treated动物。总之,我们的数据表明,sphingosine-1磷酸受体介导信号引起FTY720废除他们体内免疫抑制可能通过阻断- 2诱导扩张,这对他们的体内免疫抑制活动是必不可少的。
自然发生的调节性T细胞(Treg)4已成为一个独特的CD4吗+T细胞主要特征子集的coexpression CD25水平高一起Forkhead转录因子FoxP3 (1,2,3)。Treg维护免疫耐受中发挥决定性的作用(2)。CD4等不同的靶细胞+和CD8+T细胞(4,5,6)和NK细胞(7),以及NKT细胞(8)和树突细胞(9),不同的免疫抑制机制包括TGF-β(10)和CTLA-4 (11描述了)。Treg是有据可查的增殖潜力和counter-regulation被认为是至关重要的一个持续的效应T细胞活化,快速扩张的Treg池建议数值平衡的免疫抑制环境(12)。在不同其他人,已经证明- 2 Treg生存和增殖发挥重要作用(13,14)。因此,Treg而不是扩张效应T细胞癌试验中测试作为免疫刺激剂支持这个概念(- 215)。最后,从小鼠模型数据进一步证实了这些临床观察,作为外围维护是必不可少的- 2天然Treg (16)。
此外,免疫抑制的潜力Treg还取决于细胞间直接接触目标细胞。因此,他们迁移到网站的免疫反应必须严格监管。二级淋巴器官物资货柜被认为是一个重要的环境Treg-mediated免疫调节(17),如淋巴结(LN)以及脾脏是策划的关键T细胞介导免疫反应(18)。很明显,一个夸张的免疫激活靶器官内,Treg也进入器官引起局部免疫调节。本着这个想法,它最近被证明在一个实验模型的急性graft-vs-host疾病(GvHD) LN-homing CD62L-expressing Treg比CD62L-negative Treg在疾病控制方面(19,20.)。相反,在一个模型慢性移植物抗宿主病,而是反映了情况的T细胞活化在受损的器官,它似乎主要CD103+Treg人口是抑制移植物抗宿主病(21)。这些观测结果符合完美最近描述各种Treg亚种群的特征截然不同的趋化因子和细胞表面受体表达模式,即。,CCR7 (22),CCR5 - (23),趋化因子受体CXCR4 (23)、CD62L - (20.,24)和CD103-expressing (21)Treg。除了数据来源于GvHD模型,我们可以最近展示的有力nephroprotective影响过继转移Treg anti-glomerular加速模型的基底膜(GBM)肾小球肾炎(GN) (25)。在这个模型中,Treg不渗透主要器官但迁移到SLO发炎,这最有可能引发轻微的抑制效应T细胞。因此,尤其是在炎症过程的早期阶段,高效LN入住率以及高增殖潜能的Treg需要有效的免疫抑制。
[4-octylphenyl] FTY720 (2-amino-2 -(2 -乙基)1,探索盐酸)是一个鞘氨醇模拟和免疫调节代理来自中国真菌Iscaria sinclarii。FTY720已经证明延长同种异体移植物存活啮齿动物和人(26,27)作为sphingosine-1磷酸(S1P)受体激动剂诱导长期S1P受体的细胞表面表达的下调。后者使封锁S1P-mediated T细胞从SLO出口,通常由S1P梯度从血液和淋巴液组织(28)。在它的各种靶细胞作用,淋巴细胞的捕获SLO和随后的诱导淋巴细胞减少被认为是主要的退出机制,防止效应T细胞进入血液和随后进入目标组织(29日)。有趣的是,免疫抑制功能后系统的长期应用FTY720已经至少部分归因于FoxP3的感应幼稚T细胞,从而诱导T细胞与监管表型(30.)。然而,这仅仅是一个在过多的机制FTY720体内引起的,因为它也已被证明能够修改淋巴内皮(28)、树突(31日)和B细胞功能(32)。
我们提供这份报告第一证据表明S1P受体激动剂FTY720强有力地抑制Treg扩散体外和体内通过抑制- 2介导促有丝分裂的信号。尽管FTY720诱导Treg捕获的SLO发炎,FTY720-exposed随后过继转移的免疫抑制效应Treg废除在两个炎症的小鼠模型。
材料和方法
动物
C57BL / 6和BALB / c小鼠(年龄6 - 12周)从哈伦实验室购买。骨髓移植实验,luciferase-expressing转基因C57BL / 6小鼠L2G85 (33)使用。年龄和使用的所有实验sex-matched控制老鼠和按照协议执行机构批准的因斯布鲁克医科大学动物保健和使用委员会,奥地利因斯布鲁克(35/9185.81 / G-07/19,奥地利联邦教育,科学和文化(BMBWK) -66.011 / 0087 - brgt / 2005)。
试剂
从分子探针CFSE和TAMRA购买。FTY720博士是一个礼物诉Brinkmann(诺华制药公司)和SEW2871从Biomol购买。Anti-CD3从BD购买生物科学。膜联蛋白V从研发检测设备系统和2,从Peprotech IL-7, IL-15。
细胞的准备
脾脏和LN被轻轻地分离单个细胞悬浊液。CD4+CD25+T细胞(Treg)磁分离使用Treg分离设备(Milteny研究)实现纯度> 95%。选定的细胞被孵化的1 h在37°C 0.5μg /毫升FTY720-treated FTY-Treg)或solvent-treated Treg (solv-Treg)后面跟着两个清洗步骤之前进一步使用。在一些实验中,Treg被孵化与增加FTY720或SEW2871浓度表示。
细胞凋亡检测
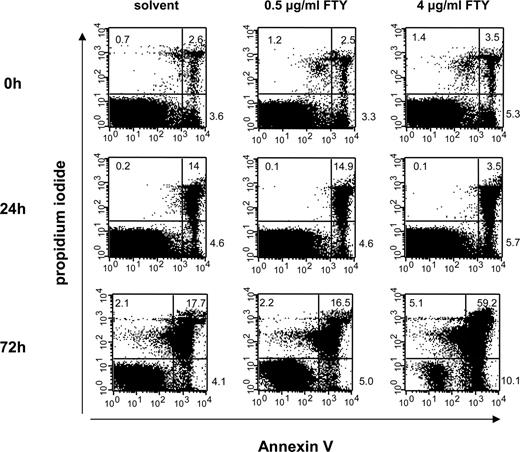
孤立Treg受到FTY720从0.5μg /毫升浓度增加到4μg /毫升,一起洗,纳入文化使用anti-CD3 100 U / ml - 2。诱导细胞死亡是由检测膜联蛋白V和碘化propidium使用流式细胞仪分析在指定的时间点。
增殖和抑制试验
确定Treg管理属性,cocultures CD4细胞+CD25−T细胞在相同数量的FTY720——或者solv-Treg进行在anti-CD3-precoated(5μg /毫升)井。人口控制,相应的T细胞单独培养。扩散测量由(5天3H]胸腺嘧啶核苷掺入β闪烁体。
Treg文化
CFSE-labeled(0.5μM) Treg 1×106/毫升和100 ng / ml培养plate-bound anti-CD3连同100 U / ml - 2 2 - 14天。刺激与anti-CD3 + 2导致细胞分裂不同CFSE荧光峰之间的歧视,让骑车(至少一个部门)和noncycled细胞,流式细胞仪分析。
流式细胞术
流式细胞仪Abs(除了anti-FoxP3 mAb)都是购自BD生物科学。Phosphospecific流式细胞术进行严格按照制造商的手册(协议3;BD生物科学)刺激后使用板绑定anti-CD3(5μg /毫升;BD生物科学)连同以下常见的γ-chain细胞因子:- 2 (100 U /毫升),IL-7 (10 ng / ml),或IL-15 (25 ng / ml)。S1P特异性FTY720-mediated对STAT-5磷酸化的影响进行了测试,使用SEW2871浓度代替FTY720从100到1000纳米。流仪分析进行FACSCalibur (BD生物科学)和数据分析与细胞追求软件(BD生物科学)。玷污了FoxP3 APC-labeled anti-mouse FoxP3马伯(eBioscience)。
西方墨点法
Treg (5×106在冰上)细胞溶解,溶解产物分析电泳10% SDS-polyacrylamide凝胶后涂抹在疏水聚乙二烯二氟化物膜(通用电气医疗集团)。鼠标anti-phosphorylated STAT-5 Ab(克隆8-5-2,稀释1/1000;微孔)和绑定添加了后来被HRP-conjugated山羊anti-mouse免疫球蛋白(稀释1:20 00;DakoCytomation)。化学发光反应是诱发使用Lumigen TMA-6工具包(通用电气医疗集团)和使用ChemiDoc XRS的墨迹图进行了分析+分子成像系统(Bio-Rad)。评估总STAT-5蛋白的表达,这些墨迹是孵化1×温和Ab剥离方案(Chemicon)和鼠标anti-STAT-5 Ab(克隆89 / STAT-5稀释1/400;BD生物科学)。
细胞因子的生产
在上层清液检测- 2和IFN-γ,FTY720或solvent-exposed T细胞和PMA / ionomycin重振。细胞因子是由ELISA检测(BD生物科学)。
过继转移和免疫荧光
FTY——solv-Treg悬浊液不同用CFSE标记(绿色)或TAMRA(红色)染料过继转移严格按照制造商的建议和随后注射注射。(5×106每个Treg人口)遵循他们的体内稳态或炎症条件下的迁移行为。后者是由南卡罗莱纳州注入0.02 g的不能存活的干燥结核分枝杆菌H37a (Difco实验室)溶解在IFA (Sigma-Aldrich)到拦路贼。七天诱导炎症后,不同标记FTY——solv-Tregs过继转移。外周血、脾脏、排水(腘),nondraining(腘,侧拦路贼注射)LN收获4-48 h Treg传输之后,随后准备作为单细胞悬液(流式细胞仪)或快速冷冻(准备组织部分)。图像是用一个正直的徕卡MZ 16 FA立体显微镜配有相机和通过MetaMorph软件(系统由Visitron实现系统)。最初的放大是×10。
急性移植物抗宿主病模型
急性移植物抗宿主病(aGvHD)诱导如前所述(34)。总之,接受者受到致命辐照与850年cGy 0天输液注射5×10紧随其后6一天后T cell-depleted骨髓细胞。诱导aGvHD 1×106CD4+/ CD8+在C57BL / 6 T细胞→BALB / c模型,分别在第二天注射输液。Treg来自捐赠者同一遗传背景的传统的T细胞(Tconv)和注射输液0天在同一剂量Tconv。幻灯片的小肠和大肠的样本收集7天被蒙蔽沾着他走时,进球和有经验的病理学家(U.V.G.)根据以前公布的组织病理学评分系统。
体内生物发光成像(BLI)
如前所述(执行BLI33)。简单地说,小白鼠注射ip与荧光素(10μg / g体重)。十分钟后,老鼠使用电荷耦合器件IVIS200成像系统成像(创建Xenogen) 5分钟。成像数据进行了分析和量化与生活图像软件(创建Xenogen)和IgorProCarbon (WaveMetrics)。
Anti-GBM GN
加速模型,对肾脏有害处的肾炎诱导(如前所述)(35)。总之,老鼠preimmunized南卡罗来纳州2毫克/毫升兔免疫球蛋白(杰克逊ImmunoResearch实验室)溶解在IFA和不能存活的干燥结核分枝杆菌H37a (Difco实验室)。两天后,动物收到3×106solv-Treg或相同数量的FTY-Treg增长值为控制,老鼠收到3×106CD4+CD25−T细胞。3天后,5毫克的heat-inactivated兔子anti-mouse GBM每20克的体重是注射抗血清。24小时尿液样本在代谢笼收集天−1,1,后7和14 GN的感应。尿白蛋白是由double-sandwich ELISA (Abcam)和尿肌酐量化spectrophotometrically使用商用设备(Sigma-Aldrich)。
组织学
Formalin-fixed组织是嵌入在石蜡,4-μm部分,减少和沾过碘酸希夫(PAS)进行组织学分析。部分从冷冻组织(4-25μm)被用于LN迁移研究以及immunoperoxidase肾脏巨噬细胞和T细胞染色(25)用一只老鼠anti-mouse巨噬细胞Ab(克隆F4/80;Serotec),一只老鼠anti-mouse CD4马伯(克隆YTS191.1;Serotec),和一个IgG2a同形像Ab -控制。Biotin-conjugated山羊anti-rat免疫球蛋白Ab(杰克逊ImmunoResearch实验室)作为二级Ab,其次是孵化avidin-biotin复杂和后续开发和他对比染色。量化了T细胞计数细胞的数量在六个相邻大功率领域肾皮质和髓质。一种半定量的评分系统进行量化的巨噬细胞:0,0到4细胞染色阳性;1 + 5 - 10细胞;2 + 10到50个细胞;3 +,50 - 200细胞;和4 +,> 200细胞染色阳性/低功耗领域。
系统性FTY720管理
FTY720管理ip在剂量为1毫克/公斤体重连续两天,而控制老鼠收到溶剂。老鼠牺牲36 h后第一个ip注入Treg和CD4的隔离+CD25−控制细胞脾和LN悬浮液。孤立的细胞培养板预镀上100 ng / ml anti-CD3连同100 U /毫升5天- 2和扩散是由(3H]胸腺嘧啶核苷掺入。
统计数据
结果表示数据从至少三个独立的生物实验。方差分析后,学生的t测试使用。的值p< 0.05被认为是重要的。数据显示±SEM手段。统计分析了使用GraphPad棱镜。
结果
FTY720对Treg生存能力的影响、表型和体外免疫抑制
只有信息几乎没有关于孤立Treg FTY720的直接影响。因此,我们分析了影响药物的特点Treg属性。首先,我们测试了FTY720对Treg生存能力的影响。使用增加剂量FTY720(0.5 4μg /毫升),我们观察到细胞死亡速率的增加只有72 h后4μg /毫升的最高剂量水平,这是有毒的各种细胞类型(图。1)。因此我们使用0.5μg /毫升的浓度对我们后续的体外和体内实验。我们下一个测试的特征属性是否Treg函数调制的短期FTY720曝光。FTY-Treg的抑制的潜力,以标准的体外抑制试验,未与solv-Treg相比,即使与CD4 FTY-Treg涨跌互现+CD25−响应者T细胞在不同的比率从1:1到1:10(图。2,一个;∗,p< 0.05为FTY和solv-Treg vs应答细胞单独)。此外,FTY-Treg压制生产IFN-γCD4 - 2+CD25−T细胞solvent-treated同行(图一样有效。2,B;∗,p< 0.05)。最后,FTY-Treg显示类似的细胞表面标记表达式(CD62L CD103, CCR7)以及细胞内FoxP3水平短期FTY720曝光后仍然没有改变(图。2C)。因此,善意的典型功能和表型特征Treg保存在短期暴露于FTY720体外。
FTY720对Treg生存能力的影响。孤立Treg暴露在浓度增加FTY720表示,随后纳入文化一起使用anti-CD3 100 U / ml - 2。细胞死亡是由膜联蛋白/ propidium碘和流式细胞仪分析在指定的时间点。阳性细胞的百分比在象限。一个代表性的实验显示(n= 3)。
Treg表型,FTY720体外功能不受影响。一个,FTY solv-Treg与CD4混合+CD25−响应者T细胞在不同的比率从1:1到1:10。扩散是一式三份取决于(3H]胸腺嘧啶核苷掺入并与纯CD4的数量的扩散+CD25−控制T细胞(100%)(∗/∗∗,p< 0.05;n每组)= 10。B,FTY——或者solv-Treg被播种在24-well板单独或混合与CD4 1:1的比例+CD25−T细胞在最后一集中5×106细胞/毫升和PMA刺激ionomycin 16 h。IFN-γ和测定- 2在上层的一式三份由ELISA和与细胞因子的生产纯CD4的数量+CD25−控制T细胞(∗∗∗,p< 0.05;n= 6)。CCD103 CD62L, CCR7表面染色及胞内FoxP3染色法和FTY——或者solv-Treg(一个代表性的例子从五个独立实验如图所示)。
Treg表型,FTY720体外功能不受影响。一个,FTY solv-Treg与CD4混合+CD25−响应者T细胞在不同的比率从1:1到1:10。扩散是一式三份取决于(3H]胸腺嘧啶核苷掺入并与纯CD4的数量的扩散+CD25−控制T细胞(100%)(∗/∗∗,p< 0.05;n每组)= 10。B,FTY——或者solv-Treg被播种在24-well板单独或混合与CD4 1:1的比例+CD25−T细胞在最后一集中5×106细胞/毫升和PMA刺激ionomycin 16 h。IFN-γ和测定- 2在上层的一式三份由ELISA和与细胞因子的生产纯CD4的数量+CD25−控制T细胞(∗∗∗,p< 0.05;n= 6)。CCD103 CD62L, CCR7表面染色及胞内FoxP3染色法和FTY——或者solv-Treg(一个代表性的例子从五个独立实验如图所示)。
FTY720-treated Treg显示严重缺陷在体外和体内增殖
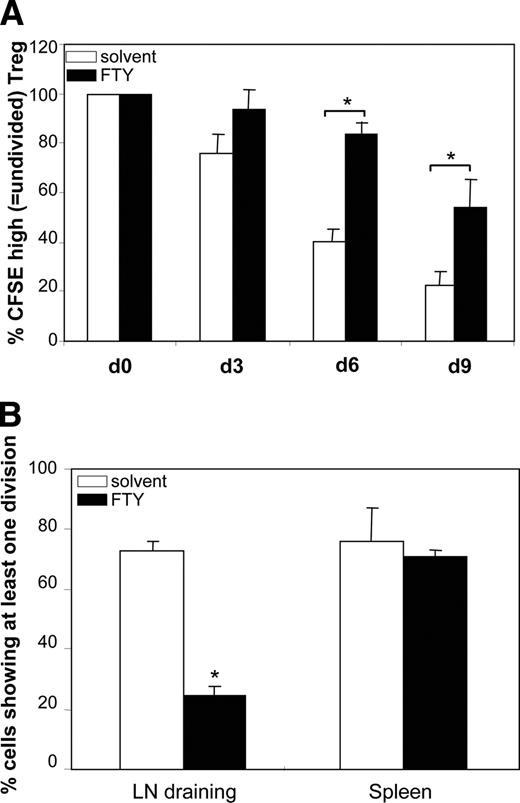
- 2的关键作用Treg扩散是有据可查(36)。因此,我们接下来关注体外Treg伸延性刺激后通过TCR - 2。solv-Treg相比,很容易扩展,FTY-Treg表现出明显受损的体外增殖(图。3,一个;∗,p< 0.05)。这些数据被证实在体内通过测量CFSE稀释在过继转移的CFSE-labeled FTY——或者solv-Treg到老鼠遭受拦路贼炎症。在这个模型中,FTY-Treg还显示一个严重减少扩张排水LN与过继转移solv-Treg相比。图中所示。3B,只有24%的FTY720-treated转移,CFSE-positive亚/输液注入体内后48 h (∗,p< 0.05),而70%的solv-Treg分裂至少一次在这个时期。这种效应在排水LN但不是仅仅检测脾脏,Treg没有48 h内增殖。
FTY720 Treg块信号- 2
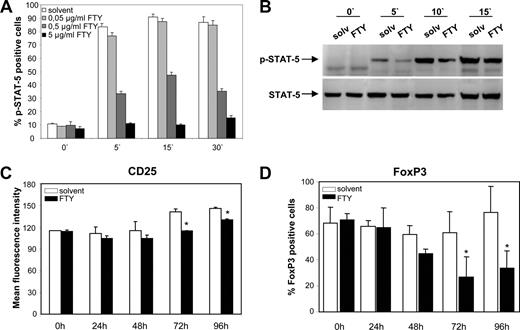
在分子水平上,我们发现FTY720暴露STAT-5 Treg剂量依赖性IL-2-induced磷酸化受损,这是一个关键组成部分的信号转导通路(图- 2。4,一个和B;∗,p< 0.05)。相比之下,溶剂接触前并没有改变IL-2-induced STAT-5磷酸化。减少敏感性IL-2-induced信号不是由下调受体- 2α-chain FTY720曝光(图。4,C)。然而,符合Treg FTY720曝光后被2的激活抑制扩散(镜像),进一步上调CD25整个文化时期的平均荧光强度(在72年和96年文化启动后h)是预防FTY720 (CD25-expressing细胞的比例保持不变在分数;数据未显示)。能够很好的证明,2 / STAT-5通路起着决定性的作用在Treg FoxP3维护(37)。因此,这是不足为奇的维护FoxP3表达在体外的文化最初FTY720-exposed Treg影响(无花果。4D)。
FTY720 Treg块信号- 2。一个和B,IL-2-induced STAT-5磷酸化(p-STAT-5) Treg暴露剂量的增加FTY720决心在指定的时间点phosphospecific流式细胞术(n每组= 8;∗,p< 0.05 vs solv-Treg) (一个)和免疫印迹(B)。CCD25表达孤立Treg FTY720或溶剂接触。数据提出了平均荧光强度在96 h政府内部在促进增长的经济文化条件和anti-CD3 - 2 (n每组= 3;∗,pvs solv-Treg p < 0.05)。D,- 2诱导体外培养的维护FoxP3表达Treg决心FTY - vs solv-Treg表示时间点(n每组= 4;∗,p< 0.05)。
FTY720 Treg块信号- 2。一个和B,IL-2-induced STAT-5磷酸化(p-STAT-5) Treg暴露剂量的增加FTY720决心在指定的时间点phosphospecific流式细胞术(n每组= 8;∗,p< 0.05 vs solv-Treg) (一个)和免疫印迹(B)。CCD25表达孤立Treg FTY720或溶剂接触。数据提出了平均荧光强度在96 h政府内部在促进增长的经济文化条件和anti-CD3 - 2 (n每组= 3;∗,pvs solv-Treg p < 0.05)。D,- 2诱导体外培养的维护FoxP3表达Treg决心FTY - vs solv-Treg表示时间点(n每组= 4;∗,p< 0.05)。
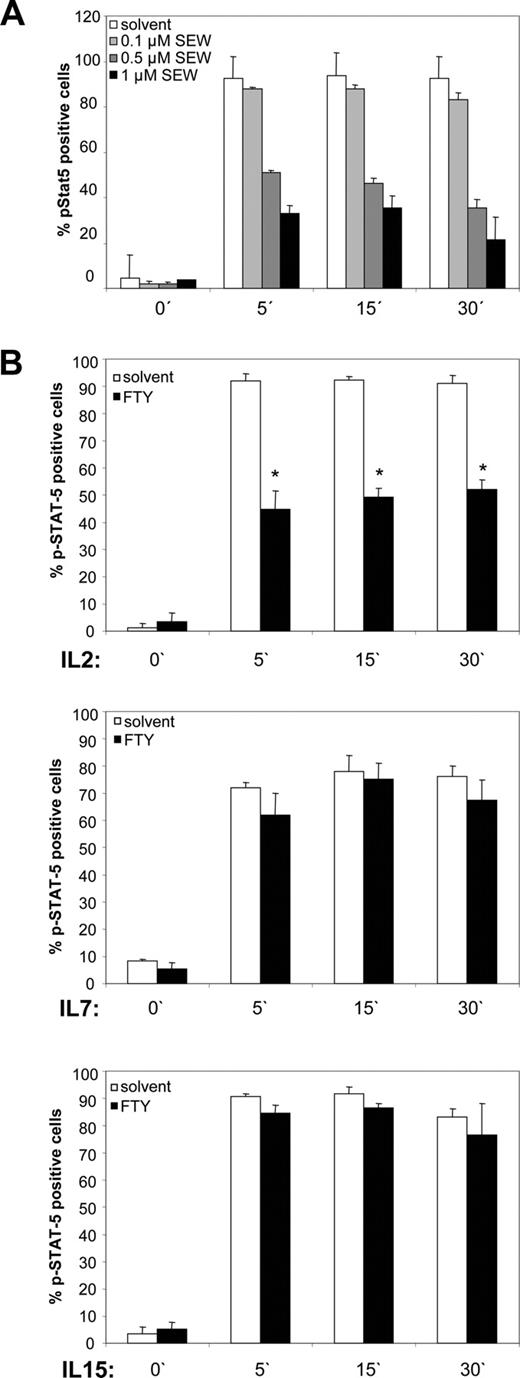
抑制STAT-5磷酸化S1P1和特定- 2
S1P受体1特异性FTY720-mediated效果证明了使用增加剂量的S1P受体1特定的受体激动剂代替FTY720 SEW2871。也符合我们之前的数据,SEW2871剂量依赖性抑制诱导STAT-5磷酸化- 2(无花果。5,一个)。值得注意的是,磷酸化的STAT-5被其他细胞因子诱导的常见γ-chain家庭(即。IL-7 IL-15)并没有阻止,FTY720(无花果。5B)。
FTY720预处理Treg废除他们的体内抑制功能
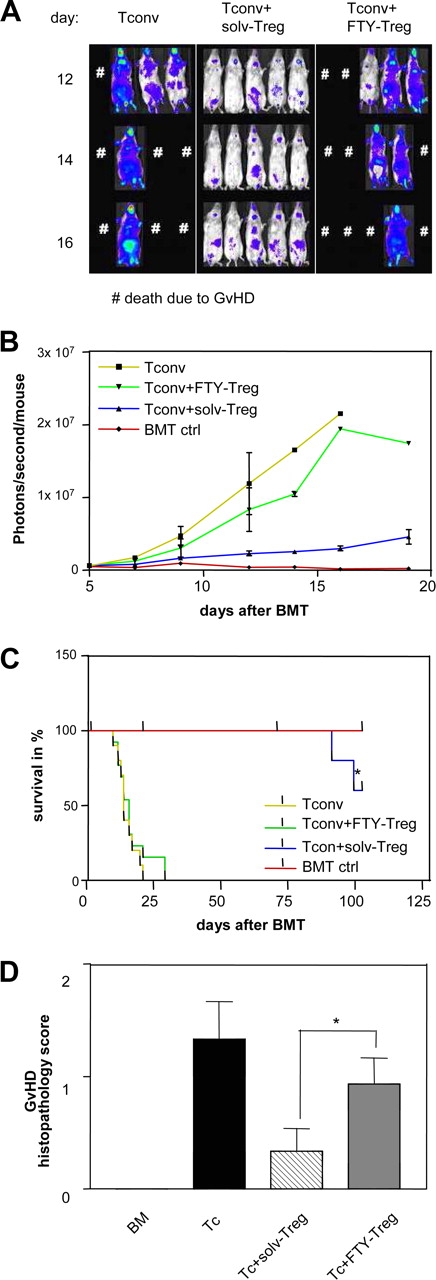
我们随后测试了受损的结果Treg S1P受体激动剂引起的扩散FTY720 Treg过继转移模型。首先,我们建立的模型用于aGvHD Treg作为同种免疫的模型能够减少杀伤力(34)。体内的扩张aGvHD-inducing T细胞被检测监控光子通过生物荧光成像,捐献者效应T细胞携带荧光素酶转基因。众所周知,发射光的程度与T细胞扩张和aGvHD严重性。符合之前的数据,cotransfer solv-Treg几乎完全阻止了荧光素酶转基因的扩张,同种异体Tconv(无花果。6,一个和B)。相比之下,Treg短期接触FTY720注射前明显减少了抑制的线索,这是反映在大规模扩张luciferase-positive效应T细胞与Tconv-transferred动物(无花果。6,一个和B)。减少抑制函数也导致显著降低集团的整体生存收到Tconv连同FTY-Treg与集团一起接收Tconv solv-Treg(无花果。6,C;∗,p= 0.001)。组织病理学评分的GvHD得分明显高于集团透露,收到Tconv一起FTY-Treg与接收Tconv + solv-Treg(无花果。6D;∗,p< 0.05)。总的来说,这些结果表明,接种的Treg FTY720损害Treg函数体内。
FTY720治疗严重损害Treg抑制函数模型的急性移植物抗宿主病。一个,代表BALB / c接受者表示组(Tconv,传统CD4 / CD8 T细胞在骨髓移植(BMT;后第二天n= 10);solv-Treg (n= 15);和FTY-Treg (n= 15))从不同的时间点(天12、14和16)BMT后显示。B,扩大荧光素酶转基因alloreactive T细胞作为量化光子每秒每只老鼠。汇集来自两个独立实验显示的数据。C、生存BALB / c与8.5 Gy, BMT致命辐照后。数据池三个独立实验的(∗psolv-Treg vs FTY-Treg p < 0.05)。D,移植后7天,老鼠从指定的组牺牲和部分小肠和大肠沾H & e .幻灯片分析病理学家蒙蔽的治疗组病理损害的证据(∗,pvs solv-Treg p < 0.05)。BM,骨髓;ctrl,控制;Tc,传统的T细胞。
FTY720治疗严重损害Treg抑制函数模型的急性移植物抗宿主病。一个,代表BALB / c接受者表示组(Tconv,传统CD4 / CD8 T细胞在骨髓移植(BMT;后第二天n= 10);solv-Treg (n= 15);和FTY-Treg (n= 15))从不同的时间点(天12、14和16)BMT后显示。B,扩大荧光素酶转基因alloreactive T细胞作为量化光子每秒每只老鼠。汇集来自两个独立实验显示的数据。C、生存BALB / c与8.5 Gy, BMT致命辐照后。数据池三个独立实验的(∗psolv-Treg vs FTY-Treg p < 0.05)。D,移植后7天,老鼠从指定的组牺牲和部分小肠和大肠沾H & e .幻灯片分析病理学家蒙蔽的治疗组病理损害的证据(∗,pvs solv-Treg p < 0.05)。BM,骨髓;ctrl,控制;Tc,传统的T细胞。
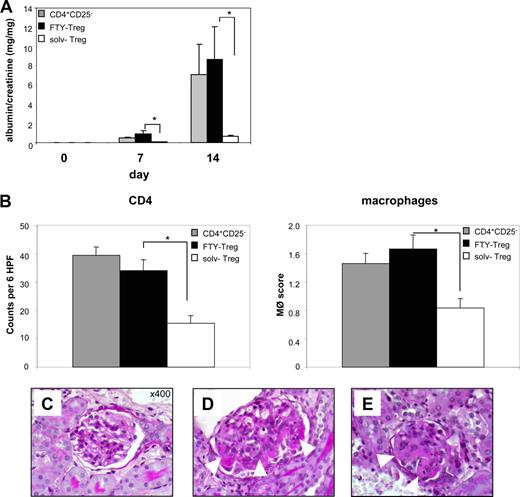
第二,anti-GBM肾炎被选为自身免疫模型测试FTY-Treg体内。根据我们以前的数据(25),solv-Treg转移到老鼠遭受anti-GBM GN强有力地抑制肾脏炎症的发展反映在显著降低蛋白尿(无花果。7,一个;∗,p< 0.05)。组织学评价显示只是偶尔PAS-positive存款,没有显示的多数肾小球病变(无花果。7,C)。根据aGvHD的数据模型,体外治疗Treg FTY720还废除他们的肾脏的炎症抑制的影响,表现出明显尿白蛋白/肌酐水平升高与动物相比接受solv-Treg(无花果。7,一个)。肾脏显示古典组织学和焦GN的迹象,如肾小球内沉积PAS-positive材料(无花果。7,D),以及提高CD4细胞的渗透+T细胞和巨噬细胞(图。7,B;∗,p< 0.05),与小鼠CD4细胞+CD25−控制T细胞(无花果。7E)。
FTY720治疗废除Treg抑制功能anti-GBM肾炎的典范。测试的免疫抑制潜力FTY-Treg我们过继转移3×106FTY-Treg或相同数量的solv-Treg anti-GBM肾炎模型。一个,Treg蛋白尿的抑制功能是由量化测量尿白蛋白/肌酐比值(n= 9每组;∗,pvs solv-Treg p < 0.05)。B通过免疫组织化学方法,分析了炎性细胞的浸润。对CD4细胞染色+T细胞(左面板)和巨噬细胞(右面板)进行诱导后14天的anti-GBM肾炎小鼠注射solv-Treg(开放酒吧),FTY-Treg(满酒吧),或CD4+CD25−控制细胞(灰色酒吧;n每组)= 9。间质巨噬细胞和CD4 (MΦ)+积累在FTY-Treg-injected显著增加小鼠相比,solv-Treg治疗小鼠(∗,p< 0.05)。高通滤波器,高功率的领域。C从肾脏部分,代表PAS染色(n=每组9)表明,在小鼠接受solv-Treg大部分没有显示的肾小球病变。D,体外FTY720对肾脏的炎症治疗Treg废除他们的抑制效果,表现出焦沉积PAS-positive材料(箭头),这是与接收CD4细胞在老鼠身上+CD25−控制T细胞(E)。
FTY720治疗废除Treg抑制功能anti-GBM肾炎的典范。测试的免疫抑制潜力FTY-Treg我们过继转移3×106FTY-Treg或相同数量的solv-Treg anti-GBM肾炎模型。一个,Treg蛋白尿的抑制功能是由量化测量尿白蛋白/肌酐比值(n= 9每组;∗,pvs solv-Treg p < 0.05)。B通过免疫组织化学方法,分析了炎性细胞的浸润。对CD4细胞染色+T细胞(左面板)和巨噬细胞(右面板)进行诱导后14天的anti-GBM肾炎小鼠注射solv-Treg(开放酒吧),FTY-Treg(满酒吧),或CD4+CD25−控制细胞(灰色酒吧;n每组)= 9。间质巨噬细胞和CD4 (MΦ)+积累在FTY-Treg-injected显著增加小鼠相比,solv-Treg治疗小鼠(∗,p< 0.05)。高通滤波器,高功率的领域。C从肾脏部分,代表PAS染色(n=每组9)表明,在小鼠接受solv-Treg大部分没有显示的肾小球病变。D,体外FTY720对肾脏的炎症治疗Treg废除他们的抑制效果,表现出焦沉积PAS-positive材料(箭头),这是与接收CD4细胞在老鼠身上+CD25−控制T细胞(E)。
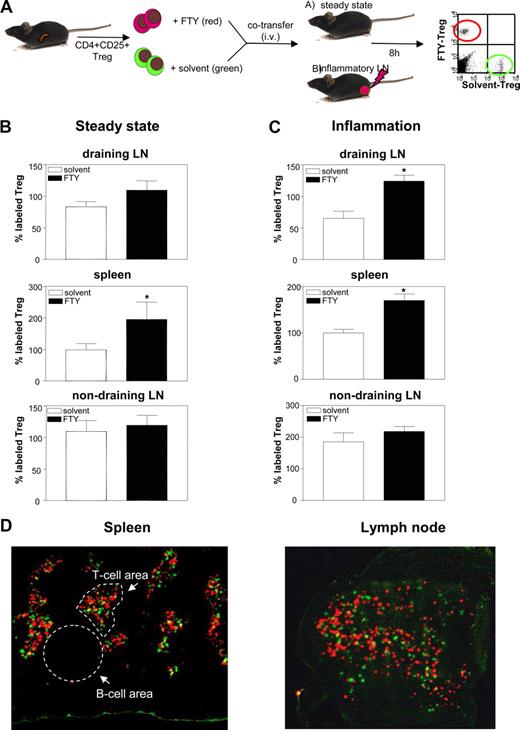
FTY720诱发的诱捕过继转移Treg发炎LN
排除额外的机制导致观察到的可能性损失Treg-mediated免疫抑制体内,我们接下来关注FTY720对Treg迁移在过继转移的影响。使用稳态条件下的一个定义良好的模型快速(即炎症。,footpad injection of mycobacteria together with Freund’s adjuvant), we i.v. coinjected TAMRA-labeled FTY-Treg together with equal numbers of CFSE-labeled solv-Treg (Fig.8,一个)。在稳态条件下,6 - 12 h后转移增加数量的FTY-Treg脾脏被发现,但不是在外围LN(无花果。8,B)。值得注意的是,尽管他们失去了免疫抑制体内的炎症模型,发炎LN的入住率Treg Treg甚至增加了体外接触FTY720(无花果。8C;∗,p< 0.05)。没有显著增加的FTY-Treg侧nondraining LN在炎症条件下检测。
一个传输的收养,FTY720诱发捕获Treg发炎LN。B和C一起,TAMRA-labeled FTY-Treg是coinjected输液相同数量的CFSE-labeled solv-Treg到老鼠在稳定状态(B)或炎症条件(C)。过继转移6到12小时后,贴上Treg的流式细胞术检测脾、排水腘,nondraining侧LN。的数字CFSE-labeled solv-Treg迁移到脾脏被设置为100%。三个独立实验的数据显示(n= 9每组动物;∗,pvs solv-Treg p < 0.05)。D,识别FTY-Treg正确定位在SLO T细胞区域,等量(3×106)的不同标记FTY-Treg(红、TAMRA)和solv-Treg(绿色,CFSE) coinjected输液在炎症条件下到老鼠。过继转移6到12小时后,低温贮藏器官。标签Treg被荧光显微镜检测(原来的放大,×10)。代表脾的例子(左面板)和LN (右面板)所示(n每组)= 4。
一个传输的收养,FTY720诱发捕获Treg发炎LN。B和C一起,TAMRA-labeled FTY-Treg是coinjected输液相同数量的CFSE-labeled solv-Treg到老鼠在稳定状态(B)或炎症条件(C)。过继转移6到12小时后,贴上Treg的流式细胞术检测脾、排水腘,nondraining侧LN。的数字CFSE-labeled solv-Treg迁移到脾脏被设置为100%。三个独立实验的数据显示(n= 9每组动物;∗,pvs solv-Treg p < 0.05)。D,识别FTY-Treg正确定位在SLO T细胞区域,等量(3×106)的不同标记FTY-Treg(红、TAMRA)和solv-Treg(绿色,CFSE) coinjected输液在炎症条件下到老鼠。过继转移6到12小时后,低温贮藏器官。标签Treg被荧光显微镜检测(原来的放大,×10)。代表脾的例子(左面板)和LN (右面板)所示(n每组)= 4。
体内定位中的Treg SLO FTY720并不改变
接下来,我们分析了定位的FTY720-exposed Treg T细胞地区SLO过继转移,因为本地化的改变也可能干扰适当Treg函数体内。因此,我们再次coinjected不同标记FTY720——solvent-exposed Treg输液进入稳定状态以及炎症条件下小鼠。如无花果所示。8D,TAMRA FTY-Treg(红色荧光)完全与CFSE-labeled solv-Treg(绿色荧光)脾脏T细胞地区和LN输液后转移到老鼠与当地拦路贼炎症。这一发现被证实在健康小鼠显示出类似的定位模式,FTY——SLO solv-Treg在稳态条件下(数据没有显示)。
短期系统性FTY720政府损害Treg扩散
最后,我们决定短期(即很感兴趣,36h) systemic FTY720 administration also affects Treg proliferative potential. In accordance with the defective proliferation of isolated Treg exposed to FTY720 in vitro, restimulation of Treg isolated from either solvent- or FTY720-exposed animals using anti-CD3 together with IL-2 resulted in a ∼40% reduced proliferation of Treg isolated from FTY720-treated animals (Fig.9)。
讨论
鞘氨醇模拟FTY720是一个有前途的免疫调节代理证明治疗效果在各种实验模型的自身免疫(26,27)。这种药物目前测试各临床试验作为一种免疫抑制剂,很快就会被批准用于治疗复发多发性硬化(38)。免疫抑制作用FTY720建议是主要在SLO介导通过淋巴细胞的捕获,从而防止出口效应T细胞进入血液和随后的靶组织条目(29日)。有趣的是,连续系统性应用FTY720或暴露后免疫抑制功能的PBMC分数的药物至少有一部分是归因于Treg感应(30.,39,40)。然而,FTY720诱发大量的机制在不同的靶细胞(即。、淋巴内皮细胞、树突、T、B细胞)(31日,32)限制的解释直接对Treg FTY720-induced影响。后者可以发挥决定性的作用在维护宽容和被认为是细胞免疫抑制剂治疗夸大自身免疫性和同种免疫的反应(41,42,43)。
我们在这份报告首次提供证据表明S1P受体激动剂FTY720 Treg扩散的有效抑制剂在体外和体内。Treg适当扩大时非常有效地刺激体外一起通过TCR - 2 (14)。因此,临床研究使用优惠扩大Treg描述免疫刺激剂(- 215),它可以解释为低- 2受体信号阈值支持Treg开发和维护(44)。接触前的孤立Treg FTY720体外几乎完全阻止Treg扩散引起的细胞刺激和2。先前的报道,已经证明S1P抑制CD4细胞的增殖反应+T细胞(45,46,47),支持T细胞抑制作用的概念S1P受体受体激动剂除了特征对淋巴细胞迁移的影响(29日)。符合我们体外观察,我们还可能会进一步表明:FTY720暴露严重损害Treg扩张过继转移后体内炎症条件下(即。模型的本地LN炎症)。最近的报告已经定义了关键作用Treg维护和扩张- 2 (44,48,49)。在分子水平上,FTY720以及S1P受体这个例子兴奋剂SEW2871,严重损害的关键组件在Treg信号通路- 2 (50),如磷酸化STAT-5和后续IL-2-induced FoxP3表达抑制的维护。有趣的是,这种抑制作用似乎是特定为- 2,我们无法发现任何抑制作用的化合物STAT-5磷酸化诱导的其他家庭成员共同γ-chain细胞因子,如IL-7和IL-15。抑制FoxP3维护文化时期最有可能是由于这一事实STAT-5结合位点位于FoxP3的启动子区域(37,50),链接- 2信号维护FoxP3的表达。这是特别重要的,FTY720并不简单地减少对Treg IL-2R表达式,表明调制干扰信号确实是- 2介导的FTY720胞内信号通路- 2。此外,接触的Treg FTY720剂量我们用于体外和体内实验并不影响其体外抑制功能(包括无力,目标T细胞增殖,抑制细胞因子和生产),不影响Treg体外生存。然而,使用两种不同的实验模型(即炎症。,aGvHD as an alloimmune model and anti-GBM GN as an autoimmune model), both of which can be inhibited by adoptive Treg transfer (25,33,51),我们能清楚地证明FTY-Treg松散他们体内免疫抑制潜在的在这两个模型。这个观察是特别令人惊讶,是因为系统性FTY720证明是添加剂的应用体外扩大Treg GVHD抑制(52),我们也提供了证据表明,FTY720诱发的高效捕获过继转移FTY-Treg SLO。后者实际上观察表明Treg LN占用的增加(尤其是在炎症条件下)将使局面有利于更多的免疫抑制环境。使用本地化拦路贼炎症模型,我们表明,FTY-Treg优先发生在炎症的归航LN和脾脏。这些数据对于FTY720对Treg迁移的影响最近的一份报告中补充证明系统性应用FTY720主要影响non-Treg T细胞群(39)。作者描述了一个数量的增加在血液和脾脏Treg但不是在LN系统性FTY720应用程序(39)。相反,我们选择一个实验装置,允许直接对Treg FTY720-induced影响的评估,这显然表明FTY720修改Treg体内迁移。因为S1P受体的封锁FTY720已表现出破坏LN架构与边缘区B细胞的位移(32,53),我们下一个检查SLO FTY-Treg的本地化。然而,cotransfer研究不同标记FTY720——solvent-treated Treg SLO证明了T细胞的适当的居住地区。这些发现是特别感兴趣的,因为尽管炎症SLO Treg的保留,他们失去了体内免疫抑制活性。我们知道从GN模型过继转移Treg主要输入SLO但不是最终器官(25)。此外,它是LN-homing, CD62L-expressing Treg分数最有力的aGvHD抑制(19,20.),支持概念Treg LN入住率Treg的免疫抑制功能是至关重要的(17)。因此,它是最有可能FTY720-induced Treg增殖的抑制Treg影响体内的损失负责。最后,我们可能会进一步证实了我们之前的研究结果表明FTY720还施加Treg抑制性影响当应用系统的方式。符合我们的体外数据,Treg孤立从动物暴露于FTY720对短期hyporesponsive 2 + TCR-induced扩散。我们的数据符合最近的一份报告显示,短期系统性增强病毒特异性CD4 FTY720治疗+和CD8+在慢性淋巴细胞性脉络丛脑膜炎病毒感染T细胞反应模型(54)。这个观察主要是解释为提高T细胞内启动SLO诱导T细胞的瞬变LN增加入住率FTY720,但是影响Treg函数体内没有解决在这个报告。我们的数据表明,伴随的抑制免疫抑制Treg也可能解释观察到的现象。这个观察是支持由刘和他的同事们最近的报告(55通过S1P受体1)证明S1P提供一种内在的负面信号激活一种蛋白激酶/哺乳动物雷帕霉素靶途径导致抑制胸腺的一代,Treg外围维护和抑制活动。
总之,我们首次展示,S1P受体激动剂FTY720诱发Treg捕获在炎症SLO,但与此同时废除他们的体内免疫抑制潜在抑制Treg扩张,这是由于抑制诱导STAT-5 - 2激活。数据突出显示的需要适当的Treg扩散后Treg过继转移诱导一种有效的免疫抑制的影响效应T细胞(即。,achievement of an optimal Treg to autoreactive or alloreactive T cell ratio) and suggest that the S1P receptor agonism induced by pharmacological agents might represent a rational approach for Treg inhibition. Finally, our data suggest that the inhibition of Treg by S1P receptor agonists might represent an innovative adjuvant for cancer immunotherapy (e.g., in combination with dendritic cell vaccines).
确认
FTY720 Volker Brinkmann博士诺华提供的慷慨。我们感谢教授戈特弗里德-拜尔对批判性阅读手稿和有用的评论。
披露的信息
D.W.接收来自诺华和议长谢礼是诺华顾问委员会成员。
脚注
这篇文章的出版成本支付部分费用的支付页面。这篇文章必须在此标记广告按照18事项部分1734只表明这个事实。
支持的项目是蒂罗尔州Landeskrankenanstalten和Medizinischer Forschungsfonds泰洛。硕士是支持的彼得·汉斯Hofschneider实验生物医学的基础。
A.M.W.设计研究,进行研究,分析数据和写的手稿。K.H. R.Z.进行研究和分析数据。西里尔·戴彼第,L.M., and M.S. performed research. A.R.R. and G.G. provided infrastructure. U.V.G. conducted blind histopathology scoring. D.W. designed the study, analyzed data, and wrote the manuscript.
这个项目已经在世界各地免疫调节在达沃斯会议二世,瑞士,2008年3月16 - 20日,在美国血液学会50年会暨博览会在旧金山,CA, 2008年12月6 - 9日。
这篇论文使用的缩写:Treg,调节性T细胞;“绿带运动”,肾小球基底膜;GN,肾小球肾炎;移植物抗宿主病,移植物抗宿主病;aGvHD急性移植物抗宿主病;FTY-Treg, FTY720-treated Treg;LN,淋巴结;不是,高碘酸希夫;SLO二级淋巴器官;solv-Treg, solvent-treated Treg; S1P, sphingosine-1 phosphate; Tconv, conventional T cell.



![图2。Treg表型,FTY720体外功能不受影响。拌,FTY——solv-Treg CD4 + CD25−响应者T细胞在不同的比率从1:1到1:10。扩散是一式三份由[3 h]决定胸苷掺入并与纯种群的扩散CD4 + CD25−控制T细胞(100%)(∗/∗∗,p < 0.05;每组)n = 10。B, FTY——或者solv-Treg被播种在24-well板单独或混合在一个1:1比例与T细胞CD4 + CD25−最后5×106个细胞/毫升的浓度和PMA刺激ionomycin 16 h。IFN-γ和测定- 2在上层的一式三份由ELISA和与细胞因子的生产纯的数量控制T细胞CD4 + CD25−(∗/∗∗, p < 0.05;n = 6)。C, CD103、CD62L, CCR7表面染色及胞内FoxP3染色FTY——或solv-Treg(一个代表性的例子从五个独立实验如图所示)。](https://aai.silverchair-cdn.com/aai/content_public/journal/jimmunol/183/6/10.4049_jimmunol.0901011/4/m_zim0180996720002.jpeg?Expires=1696479330&Signature=4IXBeovqfdtKb-6O97FlqRnCq1ApRbtyWBTZXXGSzACRtyVrY9hlNe3hyK~qfD7tyok5XCXtXVOmKydsRoB0E75BUUomLXRU54HZ4NCC3OIy98dfoql5M8q6F5xvommERfQg93UiYVG3DnYrP~Pgp4AeoyD2GmFNayYi~cDA34SAr63im9qRLGFUCZdJrjRIRFtD2ghnB2IgoQiZCWmTWBQ0Mg0wSGNVwGdPq2AQChVEQyLJ5nxzCn-KD2xq8r5WsJGVTrTCXfpKv8zHuI1WECQnpfSuCIMcTmlTrEQMEIbL7ox9xZ6w8E8nuh603a5lh6iAe~WP35weYm3W~WnjJw__&Key-Pair-Id=APKAIE5G5CRDK6RD3PGA)
![图9。短期系统性FTY720政府损害Treg扩散。FTY720注射ip在1毫克/公斤体重天0和1。控制动物注射了溶剂。36小时后第一个FTY720注入,Treg和CD4 + CD25−控制细胞一起被anti-CD3孤立和重振100 U / ml - 2。扩散是由[3 h]胸苷掺入。扩散项细胞群隔绝solvent-treated动物被设置为100% (n = 12 /组;∗,< 0.05)。](https://aai.silverchair-cdn.com/aai/content_public/journal/jimmunol/183/6/10.4049_jimmunol.0901011/4/m_zim0180996720009.jpeg?Expires=1696479330&Signature=3Spj89OEWchnPQCnWtdU0tnF6gBxrXsBG0a8pyJ0uNloRdwoQp~4FZq6KZk2X0pRfL9gNEbrohJHPOX-kGdkpAD~eQ0WvII8M4WfmG0lC1SzPg1c4JUpAKF~6Wd0lQ94FVBSGRVy8Y8tOpDzYH75Wji3boLc6V2~K1wtfFJhFsSXsnCnatn6hDpY6hCA2chCORQAX5U39XwKry0BZ9scWIRMRbF74NuoX7yfstw1ADwtzXXXmesYSP2yRmG6Ps1bNc22W1LD7LYGp3umVBysSJnNEtYPWZZGvuJwlu2d89j82s8D3te4EGD-hgCvz0QFB7E6Mop7ZpMnObLYzjb~tw__&Key-Pair-Id=APKAIE5G5CRDK6RD3PGA)