文摘
鞘氨醇的1-phosphate (S1P)受体激动剂FTY720是很出名的免疫调节活性,控制血和脾淋巴细胞的次级淋巴器官炎症,从而防止他们迁移到网站。因为炎症严重依赖之间的平衡Ag-specific Th /效应细胞和t调节细胞,我们调查了FTY720对t调节细胞活动和功能活动的影响。增加CD4的数量+/ CD25+T细胞在血液和FTY720-treated小鼠的脾脏和转让这些细胞导致更多脾脏明显积累,但不是在治疗后淋巴结,这表明这种化合物不同影响T调节细胞的导航性能相比其他T细胞的子集。事实上,CD4+/ CD25+T细胞S1P的表达水平较低1和S1P4应对S1P受体和演示一个减少的趋化作用。此外,分析FTY720-treated CD4的功能反应+/ CD25+T细胞显示增加抑制体外Ag-specific扩散试验活动。这与增强函数体内,与t调节细胞获得FTY720-treated老鼠能够抑制OVA-induced气道炎症。因此,FTY720不同影响t调节细胞的封存和重要的是,增加t调节细胞的功能活动,这表明它可能有潜在疾病修饰在炎症性疾病。
这部小说免疫调制剂FTY720,化学myriocin的导数,股票与鞘氨醇结构相似之处1-phosphate (S1P),2自然lysophospholipid已知的基本功能包括调节各种细胞存活、细胞骨架重组,和细胞活性(1,2)。FTY720成为由鞘氨醇激酶磷酸化,磷酸化形式(FTY-P)作为五项S1P受体,受体激动剂四S1P1,S1P3,S1P4,S1P5(3,4)。与传统免疫抑制剂如环孢霉素或吸收FK506, FTY720并不影响T细胞和B细胞活化,增殖和效应功能,但干扰细胞淋巴器官和血液之间的交易(5,6)。目前两个模型被提出的控制来解释淋巴细胞贩运FTY720 (7)。一个模型提出FTY720诱发内皮细胞的渗透性的变化导致的血管和淋巴血管鼻窦改变外出淋巴结的淋巴细胞。然而,更受欢迎的假设是特定站点抑制S1P-mediated淋巴细胞趋化作用原理机制负责从淋巴结淋巴细胞的减少外出。事实上,最近的一项研究表明,FTY-P诱发S1P的内化1因此,在淋巴细胞和废除S1P / S1P1端依赖外出的这些细胞淋巴器官(8)。这是发现S1P的支持1缺乏胸腺细胞不出口的胸腺和标记S1P1-deficient T细胞过继转移到辐照野生型老鼠显示明显减少外出从二级淋巴器官(8,9)。因此,FTY720导致治疗的选择性和可逆的封存从血和脾淋巴细胞到二级淋巴器官,从而防止炎症细胞的迁移对炎症和同种异体移植物排斥反应的网站(10,11,12)。事实上,毒品是非常有效的实验模型的移植和自体免疫和最近被证明是有效的在人类肾移植(13,14,15,16)。此外,我们的研究使用小鼠哮喘模型证明,FTY720强有力地抑制Th1和Th2-mediated气道炎症(17)。的OVA-induced Th1-mediated气道炎症以淋巴细胞和中性粒细胞的数量增加支气管肺泡灌洗(BAL)流体被显著地抑制口腔FTY720治疗。同样,FTY720还抑制Th2 cell-induced BAL液嗜酸性粒细胞和T淋巴细胞和嗜酸性粒细胞的浸润支气管组织。此外,Ag-induced吸入乙酰胆碱后几乎完全阻塞支气管高反应性,清楚地表明Th2-cell驱动的过敏性疾病,如哮喘可能受益于这样的待遇。
我们和其他人证明气道炎症的严重程度取决于平衡Ag-specific Th /效应和t调节细胞(18,19)。此外,多个研究也表明,CD4细胞+/ CD25+t调节细胞发挥重要作用在维护自我宽容,控制自身免疫疾病,移植排斥反应和癌症(20.,21)。这些CD4+/ CD25+t调节细胞通常是无能,独自对细胞的刺激,抑制其他CD4细胞的增殖和活化+或CD8+T细胞通过信息contact-dependent机制或抑制细胞因子il - 10等的生产和/或TGF-β(20.)。有趣的是,最近的一项研究表明,S1P似乎所需的最佳抑制效应T细胞CD4的活动+/ CD25+t调节细胞,这表明FTY720不仅可能影响交通成熟的淋巴细胞,但也可能干扰t调节细胞的功能22)。因此,我们调查了FTY720对CD4的封存和活动+/ CD25+t调节细胞。提出了研究结果清楚地表明,FTY720不同影响CD4细胞的再循环+/ CD25+t调节细胞和改变他们的功能活动,因此可能会长期在炎性疾病如哮喘疾病修改的潜力。
材料和方法
动物
C57BL / 6小鼠(5 - 8周的)是从查尔斯河实验室获得的。所有实验组年龄、性别、和重量匹配。所有实验协议符合内政部1986年动物科学法案,批准的诺华Horsham研究中心动物福利委员会。
化合物和细胞培养基
来自诺华制药,FTY720是溶解在蒸馏水中含有10%的neoral安慰剂。剂量为0.1毫克/公斤是由填喂法200年卷μl /鼠标。控制老鼠给车辆。
两个手性磷酸化FTY720的对应物,生物活性s对映体AML629和R-enantiomer AML627(至少100倍不活跃在S1P受体激动剂)是来自诺华制药。股票的解决方案准备在10毫米的浓度。这两个化合物溶解在酸化DMSO (DMSO / 50 nM盐酸)和最终的浓度1μM使用。
细胞被孵化RPMI 1640年补充l谷氨酰胺,10% heat-inactivated的边后卫,1%不重要的氨基酸混合物,5×10−5我,1×10−3丙酮酸钠,青霉素(100 U /毫升),链霉素(100μg /毫升)(所有从生命表达载体技术)。
净化的CD4+/ CD25+t调节细胞
CD4+,CD4+/ CD25+或CD4+/ CD25−从脾脏T细胞被孤立或淋巴结磁性细胞分选(mac;根据制造商的指示Miltenyi研究)。由此产生的细胞群> 95%纯由流式细胞仪分析。获得高纯度CD4的数量+/ CD25+和CD4+/ CD25−CD4 T细胞进行rt - pcr分析+细胞首先从C57BL / 6小鼠脾脏分离使用mac系统。CD4+分数就沾染了老鼠anti-mouse CD25-PE马伯(7 d4) (BD Pharmingen)和排序,流式细胞术(MoFlo;Cytomation) CD25+和CD25−分数。
增殖和迁移分析
CD4+/ CD25−和CD4+/ CD25+被隔绝OVA-immunized小鼠的脾脏。CD4+/ CD25−或CD4+/ CD25+细胞被刺激卵巢(100μg /毫升)在1×104每口井的细胞在T cell-depleted,丝裂霉素C(25μg /毫升20分钟在37°C)治疗装甲运兵车在1:1比率在96 -圆底板块。表明,CD4+/ CD25+与CD4细胞被滴定+/ CD25−细胞比例为1:2,1:4或者1:8比率和1μM FTY-P或车辆了。在一些实验中,阻止反CTLA-4(克隆没有。63828)(研发系统)或国际安全和发展理事会(Insight生物技术)添加了Abs 25μg /毫升试验的持续时间。扩散是由添加1μCi评估后5天(3H]胸苷进一步6 H之前收获和液体闪烁计数(Topcount NXT;帕卡德生物科学)。
细胞因子水平评估在重复文化48 h后使用商用ELISA试剂盒(研发系统)。
CD4细胞的反应+/ CD25+和CD4+/ CD25−对S1P研究使用24 Transwell盘子3-μm孔隙大小(BD生物科学)。分析了使用RPMI 1640有1%的脂肪无酸的BSA (Sigma-Aldrich)。众议院满载着600μl介质和S1P (Sigma-Aldrich)或媒介单独控制。CD4的心房装满0.5毫升+/ CD25+或CD4+/ CD25−细胞的浓度为1×106/毫升。试验是在37°C 3 h。细胞迁移到下议院枚举通过收集事件为一个固定的时间(30岁)FACSCalibur (BD生物科学)流式细胞分析仪。
RNA分离、cDNA准备,和实时定量PCR
获得高纯度CD4的数量+/ CD25+和CD4+/ CD25−CD4 T细胞进行rt - pcr分析+细胞首先从C57BL / 6小鼠脾脏分离使用mac系统。CD4+分数是按流式细胞术(MoFlo;Cytomation) CD25+和CD25−分数。这些T细胞亚群细胞溶解在试剂盒(生命表达载体技术)在1 - 5×106细胞/毫升和总RNA分离根据制造商的建议。总RNA resuspended RNase-free水和进一步纯化使用RNeasy迷你列(试剂盒)包括DNase I-digestion列删除任何基因污染。RNA在水和储存在−筛选了80°C。总RNA浓度和质量的评估使用RNA 6000纳米分析(安捷伦)安捷伦2100生物分析仪,和所有样本被完全删除的PCR检测基因组DNA。为实时聚合酶链反应,生成模板合成第一链cDNA使用TaqMan逆转录试剂和随机六聚物在两步rt - PCR引物从应用生物系统公司20 ng /μl总RNA。合成了在25°C Biometra T3 Thermocycler 10分钟,30分钟48°C, 95°C 5分钟。控制PCR然后使用GAPDH执行确认互补脱氧核糖核酸的合成。Gene-specific引物和探针获得Assay-on-Demand试剂从具体应用生物系统公司(Mm00475156_m1)、S1P1(S1P Mm00514644_m1)3(S1P Mm00515669_m1)4(Mm00468695_m1)和S1P5(Mm00474763_m1)。S1P的2使用底漆表达引物和探针设计软件(应用生物系统公司)。S1P的顺序2引物和探针如下:前5′-TTGCAGTGGCCAGGAACA,反向5′-CAGGTTGCCAAGGAACAGGTA,探针5′-CAAGTTCCACTCAGCAAT。
在决赛25-μl定量rt - PCR进行了一式三份卷,包含最终浓度为1×TaqMan普遍PCR大师混合包含AmpliTaq黄金DNA聚合酶(应用生物系统公司)和20 ng的目标的互补。引物浓度是900海里的正向和反向引物标记探针和250海里。所有探测目标基因标记与记者染料FAM和内部控制GAPDH基因与记者染料维克(应用生物系统公司)。实验使用ABI棱镜7700序列检测系统(应用生物系统公司)和分析使用ABI棱镜7700序列检测系统软件。放大条件如下:50°C 2分钟10分钟95°C,紧随其后的是45 95°C的周期为1分钟15秒和60°C。标准曲线为每个目标和内部控制生成基因利用鼠标系列稀释cDNA准备参考RNA (Clontech)和实验样本数据表示为内部控制基因的百分比。
流式细胞术
确定CD25的百分比+或CD62L+淋巴细胞在脾脏和淋巴结FTY720-treated和未经处理的小鼠白细胞是沾fluorochrome-conjugated鼠anti-mouse CD25马伯(7 d4)或鼠anti-mouse CD62L (MEL-14) (BD Pharmingen)。Isotype-matched马伯作为消极的控制。流式细胞术进行了FACSCalibur (BD生物科学)和数据分析了CellQuest软件(BD生物科学)。
OVA-sensitization和挑战模式
C57BL / 6小鼠免疫ip与10 0和14天μg鸡卵子(V级;Sigma-Aldrich) 0.2毫升的明矾(美国赛瓦)。21天,动物受到了20分钟的气溶胶卵子在无菌PBS(50毫克/毫升)或PBS。在指定的时间点,BAL收集注射0.4毫升的PBS三次进入肺部。总活菌数测定以及cytospin准备(Shandon科学)。细胞被沾DiffQuick(巴克斯特戴德)和微分计算使用标准执行的200个细胞形态学标准。
CFSE细胞标记和追踪
CD4+/ CD25+和CD4+/ CD25−细胞被resuspended 5×107在PBS /毫升。CFSE(分子探针)添加到最终的浓度0.5μM,悬挂在37°C孵化10分钟。潜伏期结束时,这些细胞被立即洗了三次在寒冷的RPMI 1640/10% FCS。CFSE-labeled细胞转移输液5×10到接受者6细胞/鼠标。一个小时之后,动物对待FTY720(0.1毫克/公斤)或车辆。荧光细胞的百分比在脾脏和淋巴结被流式细胞术分析。
t调节细胞的过继转移
捐赠者C57BL / 6小鼠服用0.1毫克/公斤FTY720或车辆连续3天。收集脾脏CD4的最后治疗隔离后24 h+/ CD25+t调节细胞,然后转移到受者免疫前24小时Ag)的挑战。在一些实验中,t调节细胞从天真的未经处理的小鼠和preincubated体外分离1μM活动(AML629)或非活动(AML627)对映体FTY-P过继转移前16 h。平衡液嗜酸性粒细胞和淋巴细胞测定48 h后Ag)的挑战。
统计分析
结果代表至少有三个独立的实验。标准统计软件包进行分析的数据方差分析其次是不成对学生的一种方式t测试未配对的价值观。的值p< 0.05被认为是显著的。结果表示为±SEM手段。
结果
增加CD4的数量+/ CD25+在血液和脾脏淋巴细胞治疗和FTY720天真的老鼠
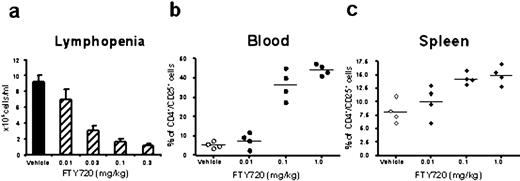
FTY720行为选择性和可逆控制血和脾淋巴细胞的淋巴结和派尔集合淋巴结补丁(8,10,21)。然而,多项研究表明,淋巴细胞从循环的损耗并不完整,表明T细胞亚群的存在对FTY720 (23,24)。因为人们很少知道FTY720对CD4的封存+/ CD25+t调节细胞,淋巴细胞亚群的分布在治疗后血和脾FTY720调查。不同剂量的FTY720被口头管理C57BL / 6小鼠连续三天。血液、脾脏和淋巴结收集24小时后治疗。正如所料,FTY720治疗导致剂量依赖性降低血液淋巴细胞,达到最大抑制浓度为0.1毫克/公斤(无花果。1,一个)。剩下的血淋巴细胞进行分析通过流式细胞术CD4的存在+/ CD25+T细胞。如无花果所示。1,b,显著提高CD4细胞的相对比例+/ CD25+治疗后T细胞被发现与FTY720与vehicle-treated老鼠相比,再次达到最大水平在0.1毫克/公斤。同样增加CD4的数量+/ CD25+在脾脏T细胞也发现(无花果。1,c),但没有淋巴结(数据未显示)FTY720-treated组的老鼠。这些数据表明,复合不同可能影响至少一个族群的CD4的封存+/ CD25+t调节细胞。事实上,最近已被证明,FTY720不同影响t调节细胞的淋巴结封存缺乏淋巴结归巢受体CD62L (25)。因此,剩余t调节细胞获得FTY720-treated小鼠的脾脏CD62L的表达进行了分析。如无花果所示。2的比例显著降低CD62L表达t调节细胞被发现在FTY720-treated小鼠的脾脏,清楚地表明S1P受体受体激动剂不同影响的一个子集的归航t调节细胞进入淋巴组织。
增加CD4+/ CD25+T细胞在血液和FTY720-treated小鼠的脾脏。C57BL / 6小鼠治疗剂量的增加FTY720(0.01 - 1毫克/公斤)或车辆连续3天。一个血,总淋巴细胞计数(±SEM,n= 8老鼠/组)。血(b)、脾(c)CD4+/ CD25+最后治疗后细胞24小时通过流式细胞术分析。数据显示为CD4的百分比+/ CD25+动物细胞从四个人。
FTY720不同影响CD4的归航+CD25+/ CD62L低脾脏和淋巴结T细胞。C57BL / 6小鼠接受FTY720或车辆作为图中描述。1。CD4+从脾脏细胞被孤立的(一个)和淋巴结(b)和分析的表达CD25和CD62L流式细胞术。c代表直方图的细胞分离车辆或FTY720-treated小鼠的脾脏和淋巴结的变化比CD62L FTY720治疗后低/高细胞。数据意味着±SEM,n=每组8只老鼠;∗,p< 0.05。
CFSE-labeled CD4+/ CD25+在脾脏T细胞优先积累但不是FTY720治疗后淋巴结
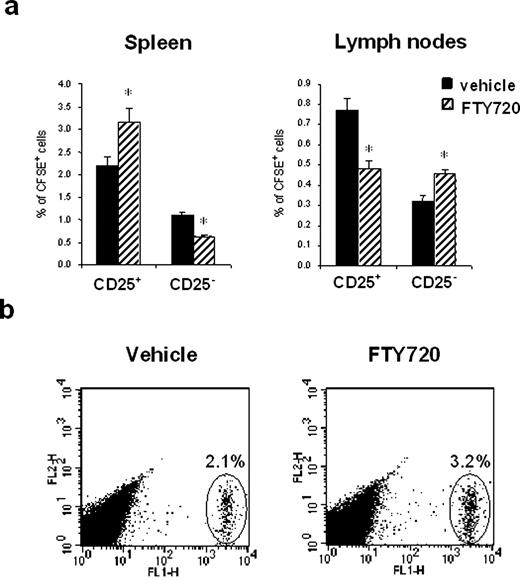
回答的问题是否CD4的增加+/ CD25+动物的脾脏T细胞FTY720-treated确实是由于这些细胞的反应的差异FTY720和不是一个T细胞活化的结果,细胞标记细胞进行了跟踪实验。为此,CD4细胞+/ CD25+和CD4+/ CD25−从幼稚细胞被孤立,未经处理的C57BL / 6小鼠,用CFSE标记和转移增长值(5×106/鼠标)到另一群天真的接受者老鼠。老鼠然后接受单剂量FTY720(0.1毫克/公斤)或车辆。24小时后,脾脏和淋巴结被移除和CD4细胞+T细胞分离和分析通过流式细胞术CFSE-positive细胞的存在。CFSE-positive CD4的显著增加+/ CD25+FTY720治疗后T细胞在脾脏被发现与vehicle-treated老鼠(图。3)。相比之下,显著降低CFSE-labeled CD4的数量+/ CD25+T细胞被发现的淋巴结FTY720-treated老鼠。这些数据是预期的鲜明对比和天真的CD4的观察+FTY720治疗后T淋巴细胞内积累淋巴结和CD4标明不同的响应+/ CD25+这药T细胞。事实上,显著增加CFSE-labeled CD4的数量+/ CD25−在淋巴结T细胞被发现,而CD4的数量+/ CD25+T细胞是显著降低(图。3)。
微分S1P受体的表达和功能对S1P CD4之间+/ CD25+和CD4+/ CD25−T细胞
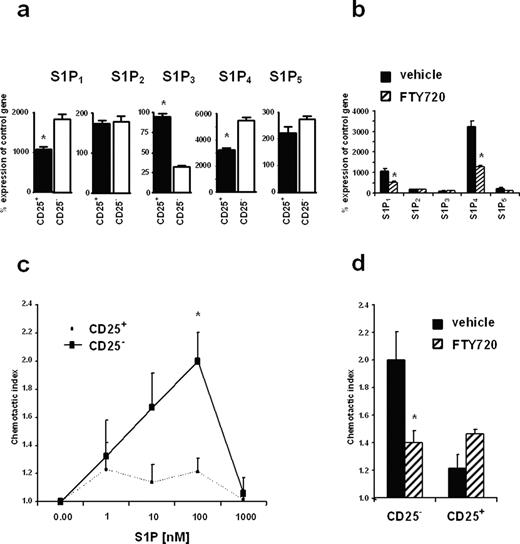
分析是否发散FTY720对CD4细胞的影响+/ CD25+和CD4+/ CD25−T细胞可能的结果不同的S1P受体的表达模式和功能的反应这两个淋巴细胞S1P子集,高纯度,FACS-sorted CD4+/ CD25+和CD4+/ CD25−T细胞获得分析了天真的C57BL / 6小鼠的脾脏S1P受体的分布定量rt - pcr。两个细胞群表达mRNA五S1P受体(无花果。4,一个)。此外,S1P的水平1和S1P4相比明显高于其他三个受体。有趣的是,CD4+/ CD25+T细胞S1P的只有∼50%的表达1和S1P4信使rna与CD4相比+/ CD25−T细胞。相比之下,CD4+/ CD25+T细胞含有较高水平的S1P3信使rna。没有可检测的定量差异在S1P的表达2和S1P5信使rna。前治疗小鼠FTY720 CD4的隔离+/ CD25+和CD4+/ CD25−T细胞减少导致了∼50% S1P的表达1和S1P4在这两种T细胞(图子集。4b)。相比之下,S1P的mRNA水平2,S1P3,S1P5治疗没有显著影响。
CD4+/ CD25+和CD4+/ CD25−T细胞表达不同程度的mRNA S1P受体和对S1P的反应不同。定量rt - pcr对S1P1 - 5从新鲜分离CD4基因+/ CD25+和CD4+/ CD25−天真的小鼠脾脏T细胞(一个),CD4+/ CD25+细胞从脾脏分离FTY720(0.1毫克/公斤)的vehicle-treated C57BL / 6小鼠(b)。数据提出了控制GAPDH基因的表达的平均百分比。c,刚分离CD4趋化现象的反应+/ CD25+和CD4+/ CD25−T细胞S1P。d,CD4细胞的趋化性+/ CD25+和CD4+/ CD25−从车辆或FTY720-treated小鼠T细胞S1P的最佳浓度(100海里)。数据是代表三个独立的实验;∗,p< 0.05。
CD4+/ CD25+和CD4+/ CD25−T细胞表达不同程度的mRNA S1P受体和对S1P的反应不同。定量rt - pcr对S1P1 - 5从新鲜分离CD4基因+/ CD25+和CD4+/ CD25−天真的小鼠脾脏T细胞(一个),CD4+/ CD25+细胞从脾脏分离FTY720(0.1毫克/公斤)的vehicle-treated C57BL / 6小鼠(b)。数据提出了控制GAPDH基因的表达的平均百分比。c,刚分离CD4趋化现象的反应+/ CD25+和CD4+/ CD25−T细胞S1P。d,CD4细胞的趋化性+/ CD25+和CD4+/ CD25−从车辆或FTY720-treated小鼠T细胞S1P的最佳浓度(100海里)。数据是代表三个独立的实验;∗,p< 0.05。
这些数据表明,CD4细胞+/ CD25+T细胞可以表达S1P的较低水平1和S1P4S1P受体,这可能会改变它们的功能反应。因此,CD4细胞的趋化现象的反应+/ CD25+和CD4+/ CD25−T细胞S1P进行了分析。如无花果所示。4c,T细胞迁移子集对S1P梯度。此外,符合低S1P的mRNA表达1和S1P4受体,在CD4显著降低反应被发现+/ CD25+T细胞的子集。相比之下,没有区别的趋化反应基质细胞衍生因子1 (3 ng / ml)观察两个子集之间的(数据没有显示)。
进一步调查这个观察,细胞也分析他们的趋化反应S1P FTY720治疗后。再一次,与S1P的mRNA表达一致1和S1P4CD4受体FTY720治疗后+/ CD25−T细胞表现出显著降低趋化现象的应对S1P(无花果。4d)。相比之下,CD4细胞中没有发现显著差异+/ CD25+T细胞的子集,尽管进一步减少S1P的信使rna1和S1P4受体被发现后,这些细胞FTY720治疗。因此,这些数据表明,CD4细胞+/ CD25+T细胞S1P减少响应,这改变了反应可能解释的差异在封存FTY720治疗后体内T细胞子集。
CD4+/ CD25+从FTY720-treated小鼠t调节细胞抑制过敏性气道炎症
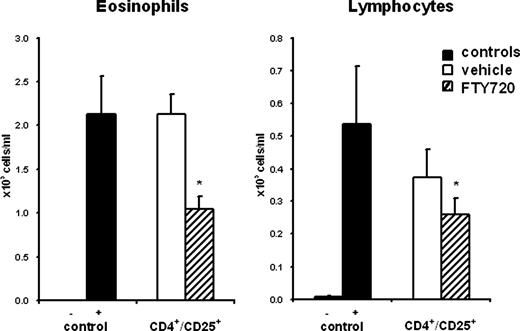
接下来,我们试图分析这些CD4是否+/ CD25+T细胞确实发挥T调节细胞的活动。为了解决这个问题,CD4细胞+/ CD25+从脾脏T细胞得到天真的小白鼠进行预处理与车辆或0.1毫克/公斤FTY720连续三天。这些细胞被注入了静脉输液为5.0×105/鼠标(最佳的细胞数量,确定初步实验)为积极OVA-sensitized C57BL / 6小鼠雾化过敏原暴露前24小时。呈现在我们先前的研究,过敏原挑战诱发气道嗜酸性特征炎症反应与显著增加数量的平衡液嗜酸性粒细胞,中性粒细胞和淋巴细胞(26)。尽管CD4转移+/ CD25+细胞从老鼠vehicle-treated没有影响OVA-induced气道炎症,CD4细胞+/ CD25+动物细胞FTY720-treated抑制气道嗜酸性粒细胞的浸润和淋巴细胞进入剂量依赖性的方式(图5)。因此,CD4+/ CD25+T细胞获得FTY720供者预处理小鼠脾脏的包含更多的T调节细胞或T调节细胞更活跃,因此,能够抑制一个allergen-induced气道炎症。
CD4+/ CD25+从FTY720-treated小鼠t调节细胞抑制过敏性气道炎症。C57BL / 6小鼠接受FTY720或车辆作为图中描述。1。CD4+/ CD25+t调节细胞被孤立于脾脏和转移到免疫接受者24小时前在最佳数字(5×10 Ag)的挑战5细胞/鼠标)。平衡液嗜酸性粒细胞和淋巴细胞测定48 h后Ag)的挑战。数据意味着±SEM,n=每组8只老鼠;∗,p< 0.05。
FTY720增加体外t调节细胞活动
进一步调查发现FTY720不仅在浓缩过程中发挥作用的t调节细胞在脾脏也改变其功能活动,一个经典的体外增殖试验。CD4+/ CD25+和CD4+/ CD25−从脾脏T细胞隔离OVA-sensitized C57BL / 6小鼠体外刺激与卵子5天FTY720的存在与否。CD4+/ CD25+T细胞没有增殖反应特定的抗原刺激,而高扩散率与CD4观察+/ CD25−T细胞(图6,一个)。添加FTY720 CD4(1μM)+/ CD25−T细胞没有明显影响这些细胞的增殖能力(数据没有显示)。正如所料,增加CD4数量越来越多+/ CD25+从OVA-sensitized小鼠CD4 T细胞+/ CD25−T细胞数量相同的老鼠导致剂量依赖性抑制增生性反应(无花果。6,一个)。更重要的是,FTY720在文化的存在导致了更明显的抑制与vehicle-treated细胞。这些结果进一步支持通过发现t调节特异性转录因子FoxP3 (27,28)是CD4的表达显著上调+/ CD25+T细胞获得FTY720-treated老鼠与vehicle-treated相比对照组(无花果。6b)。相比之下,没有明显的表达FoxP3在CD4细胞被发现+/ CD25−细胞。
CD4+/ CD25+T细胞抑制增殖和细胞因子的生产更有说服力地表达水平的提高FoxP3 FTY720的存在。一个、核扩散CD4检测+/ CD25−和CD4+/ CD25+T细胞,分离出OVA-immunized接受者小鼠的脾脏。细胞的数量都是培养独自或1:2,CD4的比例1:4,1:8+/ CD25+对CD4+/ CD25−在存在卵巢(100μg /毫升)和装甲运兵车。扩散是由添加1μCi评估后5天(3H]胸苷进一步6 H。b,定量rt - pcr FoxP3基因。CD4+/ CD25+t调节细胞与C57BL / 6小鼠脾脏,治疗与FTY720 0.1毫克/公斤或车辆连续三天。数据提出了控制GAPDH基因的表达的平均百分比。c、细胞因子的生产以48 h来自复制文化的最佳抑制条件下,作为评估早些时候扩散试验(1:2比率)。结果被表示为一个百分比的积极控制(CD4细胞的抑制作用+/ CD25−细胞)。数据是代表三个独立的实验;∗,p< 0.05。
CD4+/ CD25+T细胞抑制增殖和细胞因子的生产更有说服力地表达水平的提高FoxP3 FTY720的存在。一个、核扩散CD4检测+/ CD25−和CD4+/ CD25+T细胞,分离出OVA-immunized接受者小鼠的脾脏。细胞的数量都是培养独自或1:2,CD4的比例1:4,1:8+/ CD25+对CD4+/ CD25−在存在卵巢(100μg /毫升)和装甲运兵车。扩散是由添加1μCi评估后5天(3H]胸苷进一步6 H。b,定量rt - pcr FoxP3基因。CD4+/ CD25+t调节细胞与C57BL / 6小鼠脾脏,治疗与FTY720 0.1毫克/公斤或车辆连续三天。数据提出了控制GAPDH基因的表达的平均百分比。c、细胞因子的生产以48 h来自复制文化的最佳抑制条件下,作为评估早些时候扩散试验(1:2比率)。结果被表示为一个百分比的积极控制(CD4细胞的抑制作用+/ CD25−细胞)。数据是代表三个独立的实验;∗,p< 0.05。
同样,生产等细胞因子il - 4和IFN-γ更抑制FTY720(图的存在。6,c)。相比之下,没有明显的FTY720对生产的影响il - 10或TGF-β是可以衡量的,这表明抑制增生性反应不是由这两种细胞因子。事实上,t调节细胞介导的抑制增殖是完全失去了通过使用一个Transwell文化系统,这表明抑制机制和信息联系相关的(数据未显示)。进一步调查负责抑制效应的潜在机制,细胞培养进行的阻塞Abs CTLA4或这个理事会,两个表面分子与抑制t调节细胞的活动(29日,30.)。如表所示我,阻止CTLA4 Abs的文化几乎完全逆转FTY720-induced增加t调节细胞的活动。相比之下,没有显著的影响可以使用阻塞了Abs对国际安全和发展理事会(数据没有显示)。综上所述,这些研究结果清楚地表明,FTY720改变信息contact-dependent t调节细胞的功能活动的机制。
CTLA-4 FTY-P增强CD4的依赖+/ CD25+T调控细胞活动
| FTY-P一个。 | CTLA-4b。 | 抑制(3H]胸腺嘧啶核苷掺入(%)。 |
|---|---|---|
| − | − | 21.4±6.1c |
| − | + | 19.9±4.2 |
| + | − | 50.6±3.7 |
| + | + | 26.2±1.7 |
| FTY-P一个。 | CTLA-4b。 | 抑制(3H]胸腺嘧啶核苷掺入(%)。 |
|---|---|---|
| − | − | 21.4±6.1c |
| − | + | 19.9±4.2 |
| + | − | 50.6±3.7 |
| + | + | 26.2±1.7 |
在1μM FTY-P使用。
Anti-CTLA-4中和Abs用于25μg /毫升。
意味着±扫描电镜;基线(3H]胸腺嘧啶核苷掺入61×10 (100%)−5cpm。
allergen-induced气道炎症的抑制体外FTY720 CD4的预处理+/ CD25+T细胞
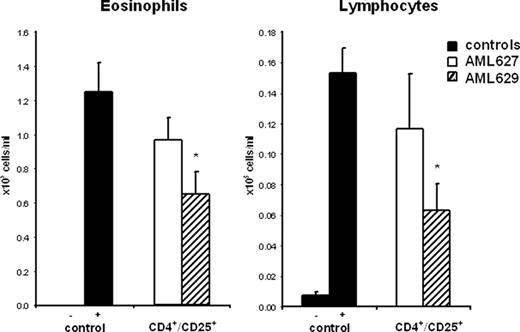
进一步调查的意义上面的体外发现与控制炎症反应,FTY720 CD4预处理+/ CD25+从天真的小鼠脾细胞过继转移到OVA-sensitized接受者在气道暴露于过敏原。CD4+/ CD25+T细胞是preincubated 16 h 1μM两种手性磷酸化FTY720的对应物,主动s对映体AML629,或不活跃R-enantiomer AML627。年底这个潜伏期,细胞被洗了,输液注入受体动物OVA-sensitized气溶胶卵子之前的挑战。气道炎症是48 h postchallenge评估。没有差异的大小嗜酸性气道炎症和阳性对照组之间的接收CD4组老鼠+/ CD25+与不活跃的细胞进行预处理对映体AML627(无花果。7)。相比之下,OVA-induced炎症反应明显抑制动物群体中CD4对待+/ CD25+细胞活性对映体AML629 preincubated,确认增加的抑制能力FTY720-treated t调节细胞,体外实验(图所示。6)。综上所述,这些数据清楚地表明,FTY720改变CD4的封存+/ CD25+t调节细胞以及它们的监管活动,因此可能会长期在炎性疾病如哮喘疾病修改的潜力。
讨论
S1P受体激动剂FTY720对淋巴细胞迁移有显著的影响在宿主防御和归巢并无明显的改变(6,10)。这些观察结果可能转移注意力从这种化合物的可能性也会调节某些淋巴细胞功能和只有少数分析细胞FTY720一直对淋巴细胞的作用机制。在这项研究中提出的数据表明,FTY720不仅不同影响CD4的封存+/ CD25+t调节细胞,也改变了他们的功能活动。更具体地说,我们表明,CD4 1)+/ CD25+t调节细胞更耐FTY720-induced封存从血和脾淋巴细胞的次级淋巴器官;2)CD4+/ CD25+t调节细胞表达的S1P mRNA水平较低1和S1P4应对S1P受体和演示一个减少的趋化作用;3)CD4+/ CD25+T细胞获得FTY720供者预处理小鼠的脾脏包含allergen-induced调节性T细胞的能力,抑制气道炎症;和4)FTY720诱发增加抑制t调节细胞的活动。
从力学上看,体外磷酸化FTY720行为作为一个五项S1P受体,受体激动剂四即S1P1,S1P3,S1P4,S1P5和是鞘氨醇激酶的底物(3,4,31日)。一项最近的研究表明,FTY720作为高亲和力S1P受体激动剂1受体在胸腺细胞和淋巴细胞,从而诱导受体的异常的内化,使这些细胞对S1P,剥夺了他们从一个义务信号到出口从淋巴器官(8,32)。因此,淋巴细胞无法再流通周围炎性组织,但仍然在淋巴功能室。虽然消耗的血淋巴细胞达到80%在大多数实验条件,包括我们自己的,值得注意的是有20%的淋巴细胞的循环不应对药物(23)。同样,在非人灵长类动物对待FTY720 > 100天,∼外周血CD4的5%+T细胞和30%的CD8 T细胞是耐火材料消耗的药物(24)。目前的看法是,这些细胞代表长寿效应记忆T细胞,因为与天真和中央记忆T细胞缺乏淋巴结归巢受体CCR7和CD62L驻留在nonlymphoid组织(33,34,35)。然而,我们的数据表明,至少CD4的族群+/ CD25+T细胞似乎对FTY720作为一个数量的增加的影响这些细胞是血液和注射的小鼠脾脏中发现的。此外,实验使用CFSE-labeled CD4的转移+/ CD25+和CD4+/ CD25−T细胞表明FTY720不同影响的封存T调节细胞群,因为治疗这些细胞的化合物导致增加脾脏但不是淋巴结。最近的研究表明,FTY720不同影响CD4的归航+/ CD25+CD62L−t调节细胞淋巴结(25),这表明至少有一部分t调节细胞表达子集毫无防备的效应记忆细胞表型的表达CD62L因此遵循后者细胞类型的循环模式。事实上,我们的研究结果证实这一假说,发现t调节细胞的比例明显高于FTY720-treated小鼠的脾脏,CD62L负面为主。
前款所讨论的数据表明,t调节细胞的再循环的一个子集是减少对S1P的依赖1相比之下,幼稚T细胞。这个假设是CD4进一步支持我们的研究结果+/ CD25+t调节人口表达显著降低S1P的水平1以及S1P4比CD4受体信使核糖核酸+/ CD25−T细胞。这些细胞也显示出显著降低对S1P趋化现象的反应,表明在mRNA表达的差异转化为受体表达的差异。事实上,最近的一项研究表明,T细胞S1P受体的mRNA水平总是准确反映蛋白质含量以西方墨迹图(22)。然而,我们的研究相比,这些调查人员无法发现任何差异S1P受体表达CD4之间+/ CD25+和CD4+/ CD25−细胞群(22)。此外,没有S1P的表达式2,S1P3,S1P5被发现,虽然相同的作者证明低S1P5表情CD4+T淋巴细胞在他们早期的研究(36)。这种差异是目前难以解释,可能是由于不同细胞纯化和分析方法。一种可能性来解释水平的S1P受体水平的差异,已报告是淋巴细胞的体外分离的过程可能导致激活和随后下调S1P受体(7)。然而,由于人口的细胞相比,在本研究中被暴露于相同的净化和孤立的过程,是非常不可能的人工和t调节细胞的选择性激活模型占S1P受体信使rna的微分表达式。然而,类似于他们的研究,激活诱导的T细胞S1P受体表达的急剧减少,我们发现FTY720治疗减少S1P的mRNA的表达1和S1P4在这两种细胞的数量相似的程度。再一次,和符合mRNA表达降低,CD4细胞+/ CD25−T细胞S1P显示显著降低反应。相比之下,CD4细胞中没有发现显著差异+/ CD25+T细胞的子集,表明CD4细胞+/ CD25+T细胞可能会减少响应S1P-induced趋化作用。相比之下,在一些淋巴器官,B细胞S1P的表达水平较高3比T细胞受体似乎所需的迁移在脾脏B细胞(37,38)。S1P的类似的角色3因为S1P可能存在于t调节细胞3信使rna水平明显高于t调节细胞FTY720治疗后没有变化。额外的研究,利用转基因小鼠缺乏一个或多个S1P受体或使用S1P受体subtype-specific药理工具,有必要识别受体或受体结合负责观察效果。
除了t调节细胞的差异封存FTY720治疗后,我们也可以证明这种化合物直接影响这些细胞的监管活动。FTY720添加到体外文化显著增强anti-proliferative CD4的函数+/ CD25+t调节细胞CD4 / CD25−T细胞。此外,更重要的是,CD4细胞+/ CD25+t调节细胞从老鼠体内FTY720-treated vitro-treated细胞以及抑制气道嗜酸性OVA-induced炎症反应,显然证明FTY720潜在的免疫调节相关的炎性疾病模型。
机制导致增强t调节细胞活性FTY720治疗后目前不清楚。先前的研究已经表明,S1P有能力改变CD4的活动+/ CD25+T细胞(22,36)。通过增强il - 10的生产从这个细胞群以及anti-proliferative活动幼稚T细胞S1P被发现CD4的最佳活动所必需的+/ CD25+t调节细胞。此外,除了il - 10的潜在作用,CTLA-4也建议的机制增强t调节细胞活动(29日)。与这项研究中,我们不能证明任何il - 10水平FTY720治疗后的变化。此外,增强t调节细胞活动的机制似乎是完全依赖信息联系,因为效果是完全废除使用Transwell的文化系统和增加屏蔽CTLA-4 Abs文化几乎完全逆转FTY720-induced增加t调节细胞的活动。
相比之下,我们不能完全排除这种可能性,FTY720并不直接改变t调节细胞的功能活动,但增加了这种细胞类型中CD4的数量+/ CD25+T细胞数量。与t调节细胞工作时的一个主要缺点是,没有明确的标志可以允许检测整个t调节细胞群或相对比例的CD4细胞类型+/ CD25+T细胞的子集。最好的分子标记已知今天是FoxP3,选择性地表达了在t调节细胞和必要的监管活动(27,28)。的确,FoxP3的表达被发现在CD4增加+/ CD25+从FTY720-treated小鼠T细胞获得,但目前不清楚这是由于数量的增加FoxP3表达细胞或诱导的转录因子在相同的细胞群。然而,我们的数据也表明,CD4的FTY720治疗+/ CD25+CD4 T细胞体外增强他们anti-proliferative活动+/ CD25−T细胞表明这种化合物直接影响监管功能而不是数量的细胞群。
总之,目前的研究表明S1P受体激动剂FTY720不同影响CD4的封存+/ CD25+t调节细胞导致更高比例的t调节/ t效应细胞在血液、脾、和潜在的炎症性网站。此外,我们的数据清楚地表明,FTY720还能够提高CD4细胞的活动+/ CD25+t调节细胞。事实上,t调节细胞的比率和力量的操纵FTY720可以添加在移植排斥反应或炎症或自身免疫性疾病,因为t调节细胞活动的感应除了屏蔽效应细胞的浸润炎症网站修改可能导致长期疾病。
披露的信息
e . Sawicka g . Dubois, g . Jarai m·爱德华兹,m·托马斯·a·尼科尔斯r·阿尔伯特·c·纽森诉Brinkmann, c·沃克是诺华生物医学研究所的全职员工和FTY720研发产品在公司内部。
脚注
这篇文章的出版成本支付部分费用的支付页面。这篇文章必须在此标记广告按照18事项部分1734只表明这个事实。
这篇论文使用的缩写:S1P,鞘氨醇1-phosphate;FTY-P磷酸化FTY720;落下帷幕,支气管肺泡灌洗。




![图6。CD4 + CD25 + T细胞抑制增殖和细胞因子生产更有说服力地表达水平的提高FoxP3 FTY720的存在。,扩散试验的CD4 + / CD25−和CD4 + CD25 + T细胞,分离出OVA-immunized接受者小鼠的脾脏。细胞群都是培养独自或1:2,1:4,1:8比CD4 + CD25 + CD4 + / CD25−在存在卵巢(100μg /毫升)和装甲运兵车。扩散被添加后评估5天1μCi [3 h]胸苷6 h . b,定量rt - pcr FoxP3基因。CD4 + CD25 + t调节细胞被隔绝C57BL / 6小鼠脾脏,治疗与FTY720 0.1毫克/公斤或车辆连续三天。数据提出了控制GAPDH基因的表达的平均百分比。c,细胞因子的生产以48 h来自复制文化的最佳抑制条件下,作为评估早些时候扩散试验(1:2比率)。结果被表示为一个百分比的抑制积极控制(CD4 + /细胞CD25−)。数据是代表三个独立的实验; ∗, p < 0.05.](https://aai.silverchair-cdn.com/aai/content_public/journal/jimmunol/175/12/10.4049_jimmunol.175.12.7973/5/m_zim0240524030006.jpeg?Expires=1695138401&Signature=iU6XfFrMhm-gsgNaF95QarEBags-G5tHMd52sN7Y9lZfuACHW2gsvuByoeo0W8FhgLTCx2Jl6G8EG4Uasuwx9pFjj5k4z3RU2VyBCqYHA0luuHJ63DH-XZS1us5NYwPerNYnpAayaDWTJHYfsz8qB6nG3NJZkJyJg1wVgH3ZnymQIUAyRFwp0QUM04i48cxEJzZ-JFbloTUAiuca3iHrNYsosyzNu8~idH5TqzzIdSTGLXobXZJpjtSASAXDkGKMtZndBpk7QFQvQ~4ofaeS3Xjp-9Tf2BbJ6R17LlzKs4kKdj0uXztkJXTGUOU5YF0O3uIDClbzUvOaH98opH~86w__&Key-Pair-Id=APKAIE5G5CRDK6RD3PGA)